
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Типовые задачи. Задача №1: Вычислить осмотическое давление раствора неэлектролита, в 2 дм3 которого содержится 0,25 моль вещества при 200С
Задача №1: Вычислить осмотическое давление раствора неэлектролита, в 2 дм3 которого содержится 0,25 моль вещества при 200С.
Дано: Решение:
 |
 |
Vр-ра = 2 дм3 = 2·10-3 м3 p = C(x)·R·T или
T = 293К p = (0,25 / 2·10-3) · 8,314 · 293 = 3,045·105 Па =
R = 8,314 Дж·моль-1·К-1 = 304,5 кПа

p -? Ответ: p = 3,045 · 105 Па.
Задача №2: При какой температуре (К) осмотическое давление раствора, содержащего 1,5 г хлорида калия в 1 дм3 раствора, составит 98450 Па?
Дано: Решение:
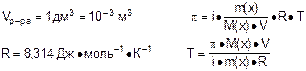 |
 p = 98450 Па Для раствора электролита:
p = 98450 Па Для раствора электролита:
m(KCl) = 1,5 г Для электролита хлорида калия:
 KCl «K+ + Cl- (a» 1, n = 2)
KCl «K+ + Cl- (a» 1, n = 2)
Т -? i(KCl) = 1 + a·(n -1)
i(KCl) = 1 +1·(2-1) = 2
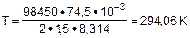 |
M(KCl) = 74,5 г·моль-1
Ответ: T = 294,06 К.
Зададча №3: Вычислить массу рибозы С5Н10О5, содержащуюся в 4 дм3 раствора при 270С, если осмотическое давление раствора рибозы составляет 84802,8 Па.

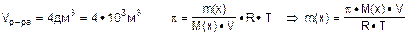 |
Дано: Решение:
Т = 300К M(С5Н10О5) = 150 г·моль-1
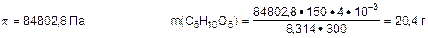 |
R = 8,314 Дж·моль-1·k-1
 |
m(С5Н10О5) -?
Ответ: m(С5Н10О5) = 20,4 г.
Задача №4: Сравните величины осмотических давлений растворов, содержащих в 1 дм3 соответственно 0,02 моль сахарозы (С12Н22О11), NaCl, MgCl2, FeCl3 при 270С.
 Дано: Решение:
Дано: Решение:
Vр-ров = 1 дм3 = 10-3 м3 p = i·C(x)·R·T, т.е. при одинаковых величинах
n(x) = 0,02 моль С(x) и Т величины осмотических давлений растворов
Вещества: С12Н22О11, NaCl, зависят от величины изотонического коэффициента (i):
MgCl2, FeCl3 i = 1 +a·(n - 1)
 i (С12Н22О11) = 1, т.к. для неэлектролитов a = 0,
i (С12Н22О11) = 1, т.к. для неэлектролитов a = 0,
Сравнить pр-ров -? i(NaCl) = 2,
i(MgCl2) = 3,
i(FeCl3) = 4.
Таким образом: p (С12Н22О11) = С(X)·R·T
p (NaCl) = 2·С(X)·R·T
p (MgCl2) = 3·С(X)·R·T
p (FeCl3) = 4·С(X)·R·T,
т.е. осмотическое давление будет больше в растворе FeCl3.
Ответ: p будет больше в растворе FeCl3.
III. Решить задачи:
1. При 00С осмотическое давление раствора глюкозы С6Н12О6 равно 56995,24 Па. Сколько граммов глюкозы содержится в 1 дм3 раствора? Ответ: m = 4,519 г.
2. Определить осмотическое давление раствора, содержащего 68,4 г сахарозы С12Н22О11 в 2 дм3 раствора при 270С. Ответ: p = 249420 Па.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 1993. – С. 70 - 76.
2. Ершов Ю.А., Кононов А. М., Пузаков С.А. и др. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учебное пособие для студентов мед. спец. вузов.- М.: Высшая школа, 1993. – С. 32 - 37.
3. Ленский А.С. Введение в бионеорганическую и биофизическую химию. – М., 1989. – С.112 - 117.
4. Материалы лекций.
ЗАДАНИЕ №9
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ СРЕДЫ – pH.
I. Подготовить ответы на следующие вопросы:
1. Уравнение ионного произведения воды, его анализ.
2. Водородный и гидроксильный показатели среды.
3. Характеристика кислотности сред по величине pH.
4. Биологическое значение водородного показателя.
II. Разобрать решение типовых задач.
ТИПОВЫЕ ЗАДАЧИ:
Задача №1: Рассчитать рН раствора соляной кислоты с молярной концентрацией вещества в растворе С(НСl) = 0,001 моль·дм-3.
Дано: Решение:
 С(HCl) = 0,001 моль·дм-3 HCl «H+ + Cl-, т.к. a = 1, то
С(HCl) = 0,001 моль·дм-3 HCl «H+ + Cl-, т.к. a = 1, то
 [H+] = [HCl] = 10-3 моль·дм-3
[H+] = [HCl] = 10-3 моль·дм-3
рН -? pH = -lg [H+]
pH = -lg10-3 = 3
Ответ: pH = 3.
Задача №2: Рассчитать pH раствора гидроксида калия с молярной концентрацией вещества в растворе C(KOH) = 1,5·10-2 моль·дм-3.
Дано: Решение:
 С(KOH) = 1,5·10-2 моль·дм-3 KOH «K+ + OH-, т.к. a = 1, то
С(KOH) = 1,5·10-2 моль·дм-3 KOH «K+ + OH-, т.к. a = 1, то
 [OH-] = [KOH] = 1,5·10-2 моль·дм-3
[OH-] = [KOH] = 1,5·10-2 моль·дм-3
рН -? pOH = -lg[OH-]
pOH = -lg1,5·10-2 = 1,82
pH + pOH = 14 Þ pH = 14 – pOH
pH = 14 – 1,82 = 12,18.
Ответ: pH = 12,18.
Задача №3: pH желудочного сока равен 1,65. Определить концентрации ионов [H+] и [OH-] в желудочном соке.
Дано: Решение:
 pH = 1,65 pH = -lg [H+]
pH = 1,65 pH = -lg [H+]
 lg [H+] = -pH Þ [H+] = 10-pH
lg [H+] = -pH Þ [H+] = 10-pH
[H+] -? [H+] = 10-1,65 = 0,0224 моль·дм-3 = 2,24·10-2 моль·дм-3
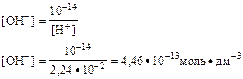 |
[OH-] -? [H+] · [OH-] = 10-14
Ответ: [H+] = 2,24·10-2 моль·дм-3
[OH-] = 4,46·10-13 моль·дм-3.
III. Решить задачи:
1. Рассчитать рН и рОН слюны, если концентрация ионов водорода в ней составляет 1,78·10-7 моль·дм-3. Ответ: рН = 6,75; рОН = 7,25.
2. Физиологическое значение рН крови 7,36. Определить концентрацию ионов [H+] и [OH-] в крови.
Ответ: [H+] = 4,37 · 10-8 моль·дм-3
[OH-] = 2,29 · 10-7 моль·дм-3.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 1993. – С. 101-107.
2. Ленский А.С. Введение в бионеорганическую и биофизическую химию. – М., 1989. – С. 142-146.
3. Материалы лекций.
ЗАДАНИЕ №10
БУФЕРНЫЕ СИСТЕМЫ
I. Подготовить ответы на следующие вопросы:
1. Буферные системы, их состав, свойства, классификация. Механизм буферного действия. Буферные растворы
2. Уравнение кислых буферных систем Гендерсона-Гассельбаха, его вывод и анализ. Зона буферного действия.
3. Буферная емкость. Факторы, влияющие на величину буферной емкости.
4. Биологическая роль буферных систем. Буферные системы крови: гемоглобиновая, оксигемоглобиновая, белковая, водородкарбонатная, фосфатная, эфиры глюкозы и фосфорной кислоты различной степени замещенности.
5. Роль водородкарбонатной буферной системы в поддержании постоянства рН крови. Ацидоз. Алкалоз. Щелочной резерв крови.
II. Подготовиться к лабораторной работе «Буферные системы и их свойства».
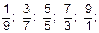
III. Рассчитать рН для пяти ацетатных буферных систем, состоящих из уксусной кислоты и ацетата натрия, учитывая, что С(СН3СОOН) = С(СН3СОONa) = 0,1 моль·дм-3, а соотношение объемов буферных компонентов [соль] / [кислота] составляет:
КдСН3СООН = 1,76·10-5.
IV. Решить задачу:
Рассчитать рН буферного раствора, состоящего из 80 см3 раствора NaH2PO4 c концентрацией С(NaH2PO4) = 0,12 моль·дм-3 и 30 см3 раствора Na2HPO4 с концентрацией С(Na2HPO4) = 0,14 моль·дм-3. Кд H2PO4- = 6,2·10-8.
Ответ: 6,84.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для мед. спец. вузов. - М.: Высшая школа, 1993. – С. 108-119.
2. Материалы лекций.
ЗАДАНИЕ №11
РУБЕЖНАЯ КОНТРОЛЬНАЯ РАБОТА №1
Подготовиться к ответам на вопросы по следующим разделам курса общей химии:
I. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
1. Термодинамика. Основные понятия и термины. Система. Фаза. Классификация систем. Термодинамические параметры. Стандартные термодинамические параметры.
2. Термодинамические функции состояния системы. Внутренняя энергия. Первый закон термодинамики, формулировка, математическое выражение, философское значение, применение к биологическим системам.
3. Термодинамические функции состояния системы. Энтальпия. Энтропия. Энергия Гиббса. Химический потенциал.
4. Термохимия. Термохимические уравнения, их особенности. Закон Гесса. Энтальпии образования и сгорания. 1-ое и 2-ое следствия из закона Гесса, формулировки, математические выражения, примеры.
5. Понятия о коэффициенте калорийности пищи. Коэффициенты калорийности основных продуктов питания: белков, жиров и углеводов.
6. Второй закон термодинамики, его формулировки. Энтропия как критерий и энергия Гиббса как главный критерий возможности самопроизвольного протекания процессов.
7. Химическое равновесие, константа равновесия. Термодинамическая характеристика химического равновесия. Уравнение изотермы химической реакции, условия равновесия и направления обратимых химических реакций.
8. Принцип Ле-Шателье, зависимость направления обратимых химических реакций от термодинамических параметров.
9. Применение термодинамики к биологическим системам. Особенности организации живых систем. Энергия пищевых веществ (продуктов питания) как основной источник энергии для человеческого организма.
10. Термодинамическая характеристика пищевых веществ и продуктов жизнедеятельности. Стационарное состояние организма и механизмы его поддержания. Теорема Пригожина.
II. РАСТВОРЫ
1. Растворы. Классификация растворов. Способы выражения концентрации растворов.
2. Образование растворов. Термодинамика растворов. Влияние энтальпийного (DН) и энтропийного факторов (DS) на величину (DG) в процессе растворения веществ
3. Растворимость веществ. Влияние на растворимость природы компонентов и внешних факторов - температуры и давления.
4. Законы Генри и Дальтона. Горная болезнь. Эмболия. Кессонная болезнь.
5. Влияние на растворимость электролитов. Закон И.М. Сеченова, его значение в физиологии.
6. Электролиты. Степень диссоциации. Константа диссоциации.
7. Сильные электролиты. Состояние ионов в растворах сильных электролитов. Межионное взаимодействие. Понятие об активности, коэффициент активности.
8. Ионная сила, ее математическое выражение, значение в биологических системах.
9. Ионное произведение воды. Водородный показатель среды растворов, его значение в кислой, щелочной и нейтральной средах. Биологическая роль водородного показателя.
10. Протолитическая (протонная) теория кислот и оснований Бренстеда и Лоури. Протолиты. Показатель константы кислотности (рКа).
11. Электронная теория кислот и оснований Льюиса. Понятие о мягких и жестких кислотах и основаниях.
12. Гидролиз. Виды гидролиза солей, привести примеры.
13. Количественные характеристики процесса гидролиза: константа и степень гидролиза. Биологическое значение процессов гидролиза.
14. Коллигативные свойства растворов. Осмос. Осмотическое давление. Биологическое значение осмоса.
15. Буферные системы, буферные растворы, их состав, свойства. Механизм действия.
16. Уравнение кислых буферных систем Гендерсона-Гассельбаха, его вывод и анализ. Зона буферного действия.
17. Буферная емкость, факторы, влияющие на буферную емкость.
18. Биологическая роль буферных систем. Буферные системы крови: гемоглобиновая, оксигемоглобиновая, белковая, водородкарбонатная, фосфатная, эфиры глюкозы и фосфорной кислоты различной степени замещенности.
19. Водородкарбонатная буферная система, ее роль в поддержании постоянства рН крови. Ацидоз. Алкалоз. Щелочной резерв крови.
III. ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ
1. Титриметрический анализ, его принципы и требования. Титрование. Фиксирование момента эквивалентности. Количественные расчеты в титриметрическом анализе.
2. Сущность метода нейтрализации. Ацидиметрия. Алкалиметрия. Применение метода в клинических и санитарно-гигиенических анализах.
3. Индикаторы метода нейтрализации. Ионная теория действия индикаторов Оствальда.
4. Зона переходной окраски индикаторов. Показатель титрования индикаторов (рТ). Выбор индикаторов с учетом значений рТ, привести примеры.
5. Оксидиметрия: сущность метода, классификация, способы фиксирования момента эквивалентности. Принцип расчета молярной массы эквивалентов окислителей и восстановителей.
6. Перманганатометрия: принцип метода, фиксирование момента эквивалентности, применение метода в медицине.
7. Окислительное действие перманганата калия в кислой, щелочной и нейтральной средах.
8. Приготовление раствора перманганата калия – титранта, условия его хранения.
IV. ТИПОВЫЕ ЗАДАЧИ
1. Способы выражения концентрации растворов – Д.З. №1.
2. Введение в титриметрический анализ – Д.З. №2.
3. Перманганатометрия – Д.З. №5.
4. Осмотическое давление растворов – Д.З. №8.
5. Элементы химической термодинамики – Д.З. № 6 и 7.
6. Буферные системы – Д.З. №10.
7. РН растворов – Д.З. №9.
ЛИТЕРАТУРА:
См. Д.З. № 1 – 10.
ЗАДАНИЕ №12
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. МЕТОД КОМПЛЕКСОНОМЕТРИИ.
I. Подготовить ответы на следующие вопросы:
1. Комплексные соединения. Строение комплексных соединений согласно теории А. Вернера (комплексообразователи, лиганды, координационные числа, внутренняя и внешняя сфера).
2. Заряд комплексного иона. Катионные, анионные, нейтральные комплексные соединения, их номенклатура. Примеры.
3. Устойчивость комплексных соединений. Константа нестойкости, уравнение изотермы.
4. Моно- и полидентатные лиганды. Хелаты. Комплексоны. Трилон «Б». Краун–эфиры.
5. Значение комплексных соединений в биологии и медицине.
II. Подготовиться к лабораторной работе «Определение общей жесткости воды комплексонометрическим методом».
III. Подготовиться к тестированному контролю по теме «Комплексные соединения». Разобрать решение типовых задач.
Date: 2015-09-24; view: 3602; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |