
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Определение основных ТЭП
Пример 1. Определите расходные коэффициенты в
производстве карбида кальция, содержащего 90%
СаС2 если сырье — антрацит марки АК с содержанием
углерода 96%, известь (негашеная) с содержанием СaО 85%.
Решение. Карбид кальция получают по реакции
выражаемой уравнением:
СаО + ЗС = СаС2 + СО,
Мг (СаС2)=64; Мг (СаО)= 56в; Аг(С)=12.
По условию в 1 т продукта содержится 900 кг СаС2.
Определим сколько оксида кальция требуется на образование 900 кг СаС2:
| Ат = | 
| кг |
С учетом чистоты СаО рассчитаем практический расходный коэффициент по извести:
| Апр = | 
| кг |
Находим, сколько углерода требуется на образование
СаС2:
| Ат2 = | 
| кг |
Определяем расходный коэффициент по антрациту:
| Апр2 = | 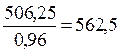
| кг |
Пример 2. Рассчитайте теоретический расходный коэффициент 18%-ного раствора едкого натра для мерсеризации 1 т целлюлозы, содержащей 5% влаги и 4% примесей.
Решение. Процесс мерсеризации целлюлозы можно выразить уравнением реакции:
[C6H7О2(OH)3]n + nNaOH→[C6H7O2(OH)2OH∙NaOH]n
Мг целлюлозы = n∙162; Мгедкого натра = 40, Найдем, сколько чистого гидроксида натрия потребуется на мерсеризацию 0,91 т целлюлозы:
| Ат = | 
| т |
18%-ного раствора требуется:
0,225/0,18 = 1,248 т.
Пример 3. Рассчитайте выход этилового спирта на пропущенный этилен при условии многократной циркуляции этилена, если практический расходный, коэффициент этилена 0,69 т на 1 т этилового спирта.
Решение. Этиловый спирт получается при взаимодействии этилена с водой:
С2Н4+Н2О↔С2Н5ОН
Молекулярные массы:
Мг (С2Н4)= 28; Мг (С2Н5ОН)=46.
Теоретический выход этилового спирта из 690 кг этилена:
mT= 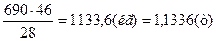
Практическая масса этанола mпракт=1000кг. Находим практический выход этилового спирта:
ή 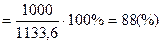
5.2. Расчёт материальных балансов
Пример 1. Составьте материальный баланс процесса нейтрализации азотной кислоты аммиаком на 1т нитрата аммония, (аммиачной селитры). Концентрация азотной кислоты 55%, газообразного аммиака—100%, нитрата аммония—85%. Потери-аммиака и азотной кислоты—1%.
Решение. Нитрат аммония получают по реакции нейтрализации:
NH3.+ HNOs=NH4NO3 + QP.
Молекулярные массы Mr(NH3)=17, Mr(HNO3)=63, Mr(NH4NO3)=80
Рассчитываем приход. В. соответствии с уравнением 1а на 1 кмоль NH3 образуется 1 кмоль NH4N03. Масса аммиака, необходимая для производства 1 т NH4NO3 (100%):
AT 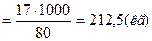
С учетом потерь производства:
Aпр=212,5·1,01=214,6 (кг)
Определяем массу азотной кислоты (100%-ной), необходимой для производства 1т NH4NO3 (AT):
АТ 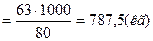
Определяем Апр-массу азотной кислоты с учетом потерь производства и концентрации HNO3:
Апр= 
С азотной кислотой поступает вода:
1446,2-795,4=640,8(кг)
Общая масса реагентов, поступивших на нейтрализацию:
214,6+1446,2=1660,8(кг)
Определяем расход 85%-ного раствора нитрата аммония, получается:
1000:0,85=1176,47(кг).
Потери HN3 составляют:
795,-787,5=7,9(кг)
Масса испарившейся воды (соковый пар) составляет:
1660,8-(1176,47+2,1+7,9)=474,33(кг)
Результаты расчётов сведены в таблицу.
Таблица 2
Материальный баланс процесса нейтрализации азотной кислоты аммиаком
| Приход | Расход | ||
| Исходное вещество | m,кг | Продукт | m,кг |
| HNO3 H2O NH3 | 795,4 650,8 214,6 | NH4NO3 (в пересчёте на 100%) H2O (соковый пар) Потери NH3 Потери HNO3 | 176,47 474,63 2,1 7,9 |
| Итого | 1660,8 | 1660,8 |
Пример 2. Составьте упрощенный материальный баланс производства этилового спирта прямой гидратацией этилена. Состав исходной парогазовой смеси (в % по объёму): этилен – 60, водяной пар – 40. Степень гидратации этилена – 5%.Расчет вести на 1 т этилового спирта. Побочные реакции и давление не учитывать.
Решение. Получение этилового спирта прямой гидратацией этилена осуществляется при температуре 560К и давлении 80·105Па по реакции, протекающей по уравнению
CH2=CH2+H2O↔C2H5OH+Qр
Молекулярные массы: Mr(C2H4)=28, Mr(H2O)=18, Mr(C2H5OH)=46
Приход. Определяем теоретический расход этилена:
АТ 
Тогда практический расчёт этилена с учетом степени превращений составит:
608,7:0,05=12174(кг) или  (м3).
(м3).
Находим объём водяного пара в парогазовой смеси:
 (м3) или
(м3) или  (кг)
(кг)
Расход. Определяем, сколько водяного пара израсходовано на гидратацию:
9739,3·0,05=486,97(м3)
Находим избыток водяного пара (проскок):
6492,8-486,97=6005,8 (м3) или 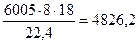 (кг)
(кг)
Рассчитываем массу непрореагировавшего этилена:
12174-608,7=11565,3 (кг) или 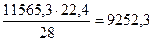 (м3).
(м3).
Полученный данные сводим в таблицу.
Таблица 3
Материальный баланс производства этилового спирта прямой гидратацией этилена
| Приход | Расход | ||||
| Исходное вещество | m,кг | V,м3 | Продукт | m,кг | V,м3 |
| Этилен Водяной пар | 5217,5 | 9739,3 6492,8 | Этиловый спирт Непрореагировавший этилен Избыток водяного пара | 11565,3 4826,92 | 486,95 9252,3 6005,8 |
| Всего | 17391,5 | 16231,6 | Всего | 17391,5 | 15745,05 |
5.3.Расчёт тепловых балансов
Пример 1. Один из методов получения ацетилена – термоокислительный крекинг (пиролиз) метана. Вычислите стандартную теплоту этой реакции при температуре 298К.
Решение. Схема реакции термоокислительного пиролиза метана:
11CH4+5O2→2C2H2+6CO+18H2+CO2+2H2O
Рассчитаем ΔН реакции пиролиза. Энтальпию образования вещества, участвующих в реакции, найдём в таблицах.
ΔН○ кДж/моль: CH4-(-74,85); C2H2-226,75; CO – (-110,5); CO2-(-393,51); H2O - (-241,84); O2 – 0; H2 – 0.
ΔН р= 2 • 226,75+6 (—110,5) + (—393,51) + 2(—241,84)—11(—74,85)=
= -263,34 (кДж/Моль).
Так как ΔН= - Qр , Qр=263,34 кДж/моль.
Пример 2. Рассчитайте теплоту, выделяющуюся при образовании 100 кг метилового спирта из СО и Н2. Энтальпия образования (в кДж/кмоль) составляет: СО - 110 583; Н2 — 0, метилового спирта — 201 456.
Решение. Образование метилового спирта из СО и Н2 протекает по реакции, выражаемой уравнением:
СО + 2H2↔СН3ОН + Qр,
где Qp — тепловой эффект реакции.
Так как QP= -ΔН,
где ΔН — энтальпия реакции синтеза метанола, рассчитаем ΔН:
ΔН = -201455- (- 110683) = -90772 (кДж/кмоль).
Таким образом, Qp=90772 кДж/кмоль.
Рассчитаем теплоту, выделяющуюся при образовании 100 кг метилового спирта:
Q=  (кДж)
(кДж)
Где 32 – молекулярная масса метилового спирта в кг.
Составьте тепловой баланс реактора синтеза этилового спирта, где протекает реакция
СН2=СН2 + Н2О↔ С2Н5ОН + Qp (Qp=46090 кДж/кмоль),
если исходный газ имеет состав: 40%. Н2О и 60% С2Н4, скорость его подачи в реактор-гидрататор 2000 м3/ч, температура на входе 563K, а на выходе из реактора 614К, конверсия за проход этилена 5%. Теплоемкость продуктов на входе и выходе одинакова и равна 27,1 кДж/кмоль. Побочные процессы и продукты не учитывать. Потери теплоты в окружающую среду принимаем 3% от прихода теплоты.
Решение. Находим состав исходного газа:
V(C2H4)=2000*0,6= 1200 м3;
V(H2О)=800-1200*0,05=740 м3;
Определяем состав газа на выходе из реактора:
V(C2H4)=1200-1200*0,05= 1140 м3;
V(H2О)=800-1200*0,05=740 м3;
V(C2H5ОН)= 1200*0,05=60 м3.
Находим суммарный объем газа (на выходе из реактора):
V= 1140+740+60=1940 м3.
Тепловой баланс: Q1+Q2=Q3+Q4
Рассчитываем приход теплоты. Физическая теплота
газа:
Q1=2000/22,4*27,1*290 = 701696,5 кДж.
Теплота реакции:
Q2=2000/22,4*0,6*46090*0,05=123460 кДж.
___________
Всего: ∑Qприхода=825156,5 кДж.
Определяем расход теплоты. Теплота, уносимая отходящими газами:
Q3=1940/22,4*27,1*341 = 800345,4 кДж.
Q4=825156,5*0,03 = 24754,7 кДж.
___________
Всего: ∑Qрасхода=825100,1 кДж.
Процесс идет с небольшим выделением теплоты.
Date: 2015-09-24; view: 793; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |