
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения задач. Пример 1. составить молекулярное и ионное уравнения гидролиза, указать характер среды для сульфата железа (II)
Пример 1. составить молекулярное и ионное уравнения гидролиза, указать характер среды для сульфата железа (II).
Решение. 1. Напишем уравнение диссоциации соли:
FeSO4 ® Fe2+ + SO42-
2. Определим сильный и слабый электролиты. Иону Fe2+ соответствует слабое основание Fe(OH)2, иону SO42- соответствует сильная кислота H2SO4, следовательно гидролиз идет по катиону.
3. Составим ионное уравнение гидролиза (по первой ступени!): Fe2+ + HOH ® FeOH+ + H+.
В ходе гидролиза образуются ионы H+, среда кислая.
4. Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
2 FeSO4 + 2H2O ® (FeOH)2SO4 + H2SO4.
Пример 2. составить молекулярное и ионное уравнения гидролиза, указать характер среды для карбоната калия.
Решение. 1. Напишем уравнение диссоциации соли:
K2CO3 ® K+ + CO32-
2. Определим сильный и слабый электролиты. Иону K+ соответствует сильное основание KOH, иону CO32- соответствует слабая кислота H2CO3, следовательно гидролиз идет по аниону.
3. Составим ионное уравнение гидролиза (по первой ступени!): CO32-+ HOH ® HCO3-+ OH-.
В ходе гидролиза образуются ионы OH-, среда в растворе щелочная.
4. Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
K2CO3 + H2O ® KHCO3+ KOH.
Пример 3. составить молекулярное и ионное уравнения гидролиза, указать характер среды для нитрита аммония.
Решение. 1. Напишем уравнение диссоциации соли:
NH4NO2 ® NH4+ + NO2-.
2. Определим сильный и слабый электролит. Иону NH4+ соответствует слабое основание NH4OH, иону NO2- соответствует слабая кислота HNO2, следовательно гидролиз идет как по катиону так и по аниону.
3. Составим ионное уравнение гидролиза:
NH4+ + NO2- + HOH ® NH4OH + HNO2.
4. Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
NH4NO2 + H2O ® NH4OH + HNO2.
Пример 4. Вычислить рН раствора сульфата аммония, концентрацией 0,1 моль/л.
Решение. 1. Составим ионное уравнение гидролиза:
NH4+ + H2O ® NH4OH + H+.
2. Значение константы диссоциации гидроксида аммония Kd = 1,76×10-5. Вычислим константу гидролиза:

3. Найдем концентрацию ионов аммония. Согласно уравнению диссоциации сульфата аммония
(NH4)2SO4 ® 2 NH4+ + SO42-,
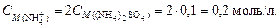
4. Вычислим концентрацию ионов [H+]:

и значение рН: рН = -lg[H+] = -lg(1,066×10-5) = 4,97.
Пример 5. вычислить степень гидролиза карбоната натрия в растворе с рН = 12.
Решение. 1. Составим ионное уравнение гидролиза:
CO32- + H2O ® HCO3- + OH-.
2. Значение второй константы диссоциации угольной кислоты Kd 2 = 4,69×10-11. Вычислим первую константу гидролиза:

3. Из формулы 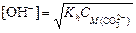 найдем концентрацию карбонат-иона:
найдем концентрацию карбонат-иона: 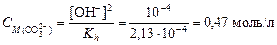 ,
,
где [OH-] = 10-pOH = 10-(14-12) = 10-2
4. Вычислим степень гидролиза

Date: 2015-09-24; view: 884; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |