
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные газовые законы
Состояние газа характеризуется его температурой, давлением и объемом. Если температура газа равна 0°С (273,15 K), а давление равно 1 атм. (1,013×105 Па = 760 мм. рт. ст.), то условия, при которых находится газ, называют нормальными.
Между объемом газа и его количеством вещества существует взаимосвязь, которая описывается законом Авогадро: в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объем. Этот объем называется молярным объемом газа VM. При нормальных условиях VM = 22,4 л и число моль газа может быть вычислено по уравнению
 . .
| (25) |
Взаимосвязь между количеством вещества газа, его температурой, давлением и объемом устанавливает уравнение Менделеева-Клайперона:
 , ,
| (26) |
где P – давление, Па; V – объем, м3; n – количество вещества, моль, m – масса, г; М – молярная масса газа, г/моль; R – универсальная газовая постоянная, в системе СИ R = 8,314 Дж/моль×K.
На практике чаще всего приходится иметь дело со смесями газов. Каждый газ вносит свой вклад в общее давление системы – парциальное давление. Парциальным давлением называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси. Парциальное давление может быть вычислено через объемное содержание газа в газовой смеси:
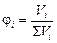 , ,
| (27) |
где Vi – объем данного газа, S Vi – общий объем газовой смеси,
или через мольную долю газа:
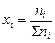 , ,
| (28) |
где ni – количество вещества данного газа, S ni – сумма числа моль всех компонентов газовой смеси
по уравнению:
| pi = xiP = j iP, | (29) |
где P – общее давление смеси газов.
Общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих данную смесь:
| P = S pi. | (30) |
Если газ собран над жидкостью, то при расчетах его парциального давления следует иметь в виду, что оно равно разности общего давления и парциального давления пара жидкости, например, для газа, собранного над водой:
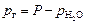 . .
| (31) |
Date: 2015-09-24; view: 910; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |