
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Подтип Трахейнодышащие (Tracheata) 3 page
Следует иметь в виду и побочные функции воздушных мешков, из которых главные:
1) устранение перегрева внутренних органов и мускулатуры при усиленной работе летательного аппарата, что достигается постоянной вентиляцией воздушных мешков);
2) предохранение внутренних органов от сотрясения и толчков при беге, полете, посадке и т.д. (воздушные мешки отделены от внутренних органов в полости тела системой пленчатых перегородок-диафрагм и образуют упругие прокладки между органами);
3) уменьшение удельного веса и повышение плавучести водоплавающих.
Основы биохимии.
1.Белки и их функции. Выделение очистка белков (хроматография, электрофорез).
Белками называют полимеры АК, связанные пептидной связью, с числом мономеров более 100. Размеры белка могут существенно варьировать и достичь тысяч АК остатков. Помимо АК в состав белков м входить и др компаненты: ионы Ме, производные витаминов, липидов, углеводов. В природе сущ достаточно большое разнообразие: у чел-ка 200 тыс, в 1 кл – 30-50, всё многообразие – млн.
Классификация беков.
-по сотаву: простые (неконъюгированные, состоят только из АК: альфа, бета-кератин, коллаген, фебоин, эластин), сложные (конъюгированные, дают и небелковые группы при гидролизе(НК, липиды, сахара, ионы Ме, гемм), сложные белки подразделяют на группы: гемопротеины, металлопротеины (ферритин), липопротеины (бета-липопротеин крови), гликопротеины (иммуноглобулин), фосфопротеины (казеин), нуклеопротеины (остаток НК, ибонуклеопротеин), флавопротеины (флавин – производн вит В2),
-по пространственной структуре: фибриллярные (альфа-кератин): линейная молекула – фибрилла, плохо растворимы в воде, вх большое кол-во гидрофобных кислот, часто выполняют структурную функцию, глобулярные (альбумин, гемоглобин): объёмная молекула – глобула, имеют более сложную структуру – гидрофобное ядро и гидрофильную пов-ть.
-по функциям:
1.Белки как ферменты. Фермент – биологический катализатор. Биол катализ происх в живой клетке – ограниченные условия (не м.б. эекстримальными).
2.Транспортная. способны доставлять множество вещ-в: межмембранный транспорт (фермиаза, K/Na-АТФаза, ферритин), транспорт м/у органами внутри организма (альбумин, гемоглобин).
3.Защитная: защита от внешней среды (внешние покровы:рога, копыта, панцирь, шерсть), защита внутри организма (иммунитет, яды).
4.Запасные, или пищевые белки (альбумин – белок яйца, козеин – белок молока).
5.Сократительная и двигательная ф-ция. Мышечн сокращения – актин-миозиновый комплекс. Флагеллин – жгутики, реснички.
6.Структурная ф-ция (альфа, бета-кертин, эластин).
7.Регуляторная ф-ция. Множество белков выступает гармонами, а также выполняет рецепторную ф-цию.
8.Прочие. обеспечивают осмогомеостаз, ьермогенез и др.
Методы выделения и очистки белков.
В основе выделения белков лежат 2 гр принципов: их дифференциальное осаждение и хроматографический метод. Для дифф осаждения исп-ся агенты, разрушающие гидратную оболочку белка. При этом падает его растворимость и он при различной концентрации осадителя выпадает в осадок: высаливание сульфатом аммония, осаждение ацетоном, осаждение спиртами.
В основе хроматографии лежит разделение молекул по их сродству к твёрдому носителю и растворителю (Цвет): ионообменная хр-я, гель-хр-я, аффинная хр-я. При ионообменной хр-ии к носителю привязываются функциональные группы, кот имеют заряд. Наиб часто исп – карбокси. Диэтиламиноэтилсефадекс. На колонку наносится смесь белков и те из них, кот заряжены максимально противоположно заряду колонки сорбируются макс эффективно. Те, у кого заряда нет, или он такого же знака, с колонки элюируется сразу. Для десорбции исп р-р с высокой ионной силой.
При гель-хр-ии разделение белков идёт по массе, что достигается применением пористого носителя. Мелкие молекулы, попадая внутрь этих пор, элюируются значительно медленнее, чем крупные.
Аффинная хр-я основана на разделении вещ-в по сродсту к определённому лиганду (либо аналог субстрату, либо антитело) самый точный, быстрый эффективный способ. Для анализа эфф-ти выдел-я белков и белкового полиморфизма исп-ся электрофорез, позволяющий получить данные о том, какие белки и сколько содержатся в данной пробе.
Электрофорез бывает 2х типов: нативный (неразрушающий) и денатурирующий. При ативном белки не разрушаются и идёт их разделение как по заряду, так и по размеру молекул. При денатуррующем электрофорезе в пробу добавляется детергент (додецилсульфат натрия), который разворачивает белковую молекулу. Вся молекула становится линейной, облепленной молекулами детергента. Разделение белков идёт по их размеру. Чем больше мол-ла, тем медленней она разделяется.
5.Гликолиз – центральный путь катаболизма глюкозы.
Катаболизм – фаза метаболизма, на которой происходит распад молекул, поступающих с пищей или запасенных живым организмом до неорганических веществ (H2O, CO2, NH4). В ходе катаболических процессов высвободившаяся при окислении энергия запасается в форме АТР, NAD(P)H и мембранного потенциала. на первой стадии происходит активация субстратов за счет фосфорилирования (затрачивается 2 АТР), включение в данный процесс других сахаров, распад на две С3 молекулы (глицеральдегид-3-фосфат и дигидроксиацетонфосфат).На втором этапе происходит окисление глицеральдегид-3-фосфата до пирувата (в аэробных условиях) или до лактата (при анаэробиозе) с образованием 4-х молекул АТР.
Глюкоза
гексокиназа
Глюкозо-6-фосфат
фосфоглюкоизомераза
Фруктозо-6-фосфат
фосфофруктокиназа
Фруктозо-1,6-бисфосфат
альдолаза
Глицеральдегид-3- фосфат Дигидроксиацетонфосфат
триозофосфатизомераза
Запасание энергии
Глицеральдегид-3- фосфат
глицеральдегид-3-фосфатдегидрогеназа
(NAD+ NADH)
1,3-дифосфоглицерат
фосфоглицераткиназа (АДР АТР)
3-фосфоглицерат
фосфоглицератмутаза
2-фосфоглицерат
енолаза
фосфоенолпируват
пируваткиназа (АДР АТР)
пируват
6.Цикл трикарбоновых кислот.
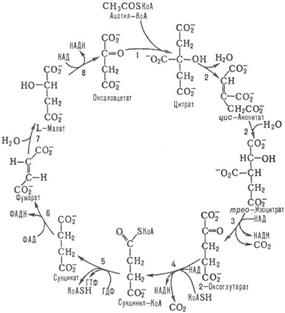
Цикл трикарбоновых кислот (цикл Кребса, цитратный цикл) — центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух- и трёхуглеродных соединений, образующихся как промежуточные продукты в живых организмах при распаде углеводов, жиров и белков, до CO2. При этом освобождённый водород направляется в цепь тканевого дыхания, где в дальнейшем окисляется до воды, принимая непосредственное участие в синтезе универсального источника энергии — АТФ.Цикл Кребса — это ключевой этап дыхания всех клеток, использующих кислород, центр пересечения множества метаболических путей в организме. Кроме значительной энергетической роли циклу отводится также и существенная пластическая функция, то есть это важный источник молекул-предшественников, из которых в ходе других биохимических превращений синтезируются такие важные для жизнедеятельности клетки соединения как аминокислоты, углеводы, жирные кислоты и др.Цикл превращения лимонной кислоты в живых клетках был открыт и изучен немецким биохимиком Хансом Кребсом, за эту свою работу он (совместно с Ф. Липманом) был удостоен Нобелевской премии (1953 год).У эукариот все реакции цикла Кребса протекают внутри митохондрий, причём катализирующие их ферменты, кроме одного, находятся в свободном состоянии в митохондриальном матриксе, исключение составляет сукцинатдегидрогеназа, которая локализуется на внутренней митохондриальной мембране, встраиваясь в липидный бислой. У прокариот реакции цикла протекают в цитоплазме.При работе цикла Кребса окисляются различные продукты обмена, в частности токсичные недоокисленные продукты распада алкоголя, поэтому стимуляцию цикла Кребса можно рассматривать как меру биохимической детоксикации.
7.Уровни структурной организации белков.
Белки́ (протеи́ны, полипепти́ды) - высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-АКт. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных АКт. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, АКты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс. Первичная структура — последовательность АК в полипептидной цепи. Важными особенностями I являются консервативные мотивы — сочетания АКт, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка.
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков: α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[15] (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали.β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток[15]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин.π-спирали;310-спирали;неупорядоченные фрагменты.
Третичная или трёхмерная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие: ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;водородные связи;гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четверичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
8.Хемиосмотическая теория Митчелла. b-окисление жирных кислот.
в соответствии с хемиосмотической теорией П. Митчелла, энергия, освобождаемая в результате работы; электронтранспортной цепи, первоначально накапливается в форме трансмембранного градиента ионов водорода. Разрядка образующегося DmH+ происходит с участием локализованного в той же мембране протонного АТФ-синтазного комплекса: Н+ возвращаются по градиенту DmH+ через Н+–АТФ-синтазу, при этом без возникновения каких-либо промежуточных высокоэнергетических соединений из АДФ и неорганического фосфата образуется АТФ. (Сами сопрягающие мембраны в интактном состоянии непроницаемы для ионов, особенно Н+ и ОН–.) Предположительно, для синтеза одной молекулы АТФ достаточен перенос двух протонов, т. е. Н+/АТФ=2. Однако не исключено, что Н+/АТФ может быть больше.Локализованная в мембране H+–АТФ-синтаза катализирует реакции синтеза и гидролиза АТФ в соответствии с уравнением:
АДФ + ФН + nHНАР+ «АТФ + H2O + nHВНУТР+
Реакция, протекающая слева направо, сопряжена с транспортом H+ по градиенту DmH+, что приводит к его разрядке и синтезу АТФ. Протекающая в противоположном направлении реакция гидролиза АТФ, сопровождающаяся переносом Н+ против градиента, приводит к образованию (или возрастанию) DmH+ на мембране. Таким образом, АТФ-синтазный ферментный комплекс служит механизмом, обеспечивающим взаимное превращение двух форм клеточной энергии (DmH+ «АТФ), устройством, сопрягающим процессы окислительной природы с фосфорилированием.
b-окисление жирных кислот.Процесс b-окисления является циклическим. За каждый оборот цикла от жирной кислоты отщепляется 2 углеродных атома в виде ацетильного остатка.После этого укороченный на 2 углеродных атома ацил-КоА снова подвергается окислению (вступает в новый цикл реакций b-окисления). Образующийся Ацетил-КоА может дальше вступить в цикл трикарбоновых кислот.Нужно уметь рассчитывать энергетический выход при распаде жирных кислот. Представленная формула верна для любой насыщенной жирной кислоты, содержащей n углеродных атомов.При распаде ненасыщенных жирных кислот образуется меньше АТФ. Каждая двойная связь в жирной кислоте - это потеря 2-х молекул АТФ.b-окисление наиболее интенсивно протекает в мышечной ткани, почках, печени.В результате b-окисления ЖК образуется Ацетил-КоА. Скорость окисления определяется скоростью процессов липолиза. Ускорение липолиза характерно для состояния углеводного голодания и интенсивной мышечной работы. Ускорение b-окисления наблюдается во многих тканях, в том числе и в печени. В печени образуется больше Ацетил-КоА, чем ей требуется. Печень - "орган-альтруист" и поэтому печень отправляет глюкозу в другие ткани.Печень стремится направить в другие ткани и свой собственный Ацетил-КоА, но не может, так как для Ацетил-КоА клеточные мембраны непроницаемы. Поэтому в печени из Ацетил-КоА синтезируются специальные вещества, которые называются "кетоновые тела". Кетоновые тела - это особая транспортная форма ацетил-КоА.
9.Биосинтез жирных кислот.
В настоящее время в достаточной степени изучен механизм биосинтеза жирных кислот в организме животных и человека, а также катализирующие этот процесс ферментные системы. Синтез жирных кислот протекает в цитоплазме клетки. В митохондриях в основном происходит удлинение существующих цепей жирных кислот. Установлено, что в цитоплазме печеночных клеток синтезируется пальмитиновая кислота (16 углеродных атомов), а в митохондриях этих клеток из уже синтезированной в цитоплазме клетки пальмитиновой кислоты или из жирных кислот экзогенного происхождения, т.е. поступающих из кишечника, образуются жирные кислоты, содержащие 18, 20 и 22 углеродных атома.Иными словами, митохондриальная система биосинтеза жирных кислот, включающая несколько модифицированную последовательность реакций β-окисления, осуществляет только удлинение существующих в организме среднецепочечных жирных кислот, в то время как полный биосинтез пальмитиновой кислоты из ацетил-КоА активно протекает в цитозоле, т.е. вне митохондрий, по совершенно другому пути.Внемитохондриальная система биосинтеза de novo жирных кислот (ли-погенез). Эта система находится в растворимой (цитозольной) фракции клеток многих органов, в частности печени, почек, мозга, легких, молочной железы, а также в жировой ткани. Биосинтез жирных кислот протекает с участием НАДФН, АТФ, Мn2+ и НСО3– (в качестве источника СО2); субстратом является ацетил-КоА, конечным продуктом – пальмитиновая кислота. Потребности в кофакторах процессов биосинтеза и β-окисления жирных кислот значительно различаются.Как отмечалось, строительным блоком для синтеза жирных кислот в цитозоле клетки служит ацетил-КоА, который в основном поступает из митохондрий. Было выявлено, что цитрат стимулирует синтез жирных кислот в цитозоле клетки. Известно также, что образующийся в митохондриях в процессе окислительного декарбоксилирования пирувата и окисления жирных кислот ацетил-КоА не может диффундировать в цито-золь клетки, так как митохондриальная мембрана непроницаема для данного субстрата. Поэтому вначале внутримитохондриальный ацетил-КоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат. Реакция катализируется ферментом цитрат-синтазой. Образовавшийся цитрат переносится через мембрану митохондрий в цитозоль при помощи специальной трикарбоксилаттранспортирующей системы.В цитозоле цитрат реагирует с HS-KoA и АТФ, вновь распадаясь на ацетил-КоА и оксалоацетат. Эта реакция катализируется АТФ-цитрат-лиа-зой. Уже в цитозоле оксалоацетат при участии цитозольной малатдегидро-геназы восстанавливается до малата. Последний при помощи дикарбокси-латтранспортирующей системы возвращается в митохондриальный мат-рикс, где окисляется до оксалоацетата, завершая тем самым так называемый челночный цикл. уществует еще один путь переноса внутримитохондриального аце-тил-КоА в цитозоль клетки – с участием карнитина. Как отмечалось, кар-нитин играет роль переносчика ацильных групп из цитозоля в митохондрии при окислении жирных кислот. По-видимому, он может выполнять эту роль и в обратном процессе, т.е. в переносе ацильных радикалов, в том числе ацетильного радикала, из митохондрий в цитозоль клетки. Однако, когда речь идет о синтезе жирных кислот, данный путь переноса ацетил-КоА не является главным.Образование малонил-КоА. Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил-КоА, для чего требуются бикарбонат, АТФ, ионы марганца. Катализирует эту реакцию фермент ацетил-КоА-кар-боксилаза. Фермент содержит в качестве простетической группы биотин. Авидин – ингибитор биотина угнетает эту реакцию, как и синтез жирных кислот в целом.Установлено, что ацетил-КоА-карбоксилаза состоит из переменного числа одинаковых субъединиц, каждая из которых содержит биотин, биотинкарбоксилазу, карбоксибиотинпереносящий белок, транскарбоксилазу, а также регуляторный ал-лостерический центр, т.е. представляет собой полиферментный комплекс.Реакция протекает в два этапа: I – карбоксилирование биотина с участием АТФ и II – перенос карбоксильной группы на ацетил-КоА, в результате чего образуется малонил-КоА. Малонил-КоА представляет собой первый специфический продукт биосинтеза жирных кислот. В присутствии соответствующей ферментной системы малонил-КоА быстро превращается в жирные кислоты.Энзиматические системы, осуществляющие синтез жирных кислот, называются жирно-кислотными синтетазами. Они широко встречаются в природе и могут быть изолированы из различных одноклеточных организмов, растений и животных тканей.Жирно-кислотные синтетазы делятся на 2 группы. К первой группе относятся полиэнзимные, не поддающиеся фракционированию комплексы с мол. м. порядка 500000, в которых все индивидуальные энзимы собраны в компактную структуру. В частности, в эту группу входят жирно-кислотные синтетазы животных тканей и дрожжей.Вторая группа включает жирно-кислотные синтетазы, из которых отдельные энзимы могут быть выделены методами белкового фракционирования. Такие синтетазы встречаются у ряда микроорганизмов (в частности, у E.coli) и растений. Иными словами, в этих случаях все индивидуальные ферменты синтетазной системы находятся в виде автономных полипептидов.Мультиферментный комплекс, называемый синтетазой (синтазой) жирных кислот, состоит из 6 ферментов, связанных с так называемым ацилпереносящим белком (АПБ). Этот белок относительно термостабилен, имеет две свободные HS-группы (цистеина и фосфопантетеинового остатка, присоединенного к ОН-группе серина) и вовлекается в процесс синтеза высших жирных кислот практически на всех его этапах. Мол. масса АПБ составляет около 10000. Данный белок в синтетазной системе выполняет роль КоА. Заметим, что в животных тканях не удалось обнаружить свободного АПБ, подобного микробному. Из печени выделен полиэнзимный комплекс, содержащий все энзимы, необходимые для синтеза жирных кислот. Энзимы комплекса настолько прочно связаны друг с другом, что все попытки изолировать их в индивидуальном виде не увенчались успехом. Приводим последовательность реакций, происходящих при синтезе жирных кислот. Далее цикл реакций повторяется. Допустим, что идет синтез пальмитиновой кислоты (С16). В этом случае образованием бутирил-АПБ завершается лишь первый из 7 циклов, в каждом из которых началом является присоединение молекулы малонил-АПБ к карбоксильному концу растущей цепи жирной кислоты. При этом отщепляется дистальная карбоксильная группа малонил-АПБ в виде СО2. Завершается синтез жирной кислоты отщеплением HS-АПБ от ацил-АПБ под влиянием фермента деацилазы. Или, учитывая, что на образование одной молекулы малонил-КоА из ацетил-КоА расходуются одна молекула АТФ и одна молекула СО2, которая затем отщепляется. По сравнению с β-окислением биосинтез жирных кислот имеет ряд характерных особенностей: синтез жирных кислот в основном осуществляется в цитозоле клетки, а окисление – в митохондриях; участие в процессе биосинтеза жирных кислот малонил-КоА, который образуется путем связывания СО2 (в присутствии биотин-фермента и АТФ) с ацетил-КоА; на всех этапах синтеза жирных кислот принимает участие ацилпереносящий белок (HS-АПБ); при биосинтезе образуется D(–)-изомер 3-гидроксикис-лоты, а не L(+)-изомер, как это имеет место при β-окислении жирных кислот; необходимость для синтеза жирных кислот кофермента НАДФН. Последний в организме частично (на 50%) образуется в реакциях пен-тозофосфатного цикла, частично – в других реакциях, в частности в реакциях:
Малат + НАДФ+-> Пируват + С02 + НАДФН + Н+ Изоцитрат + НАДФ+-> α-Кетоглутарат + С02 + НАДФН + Н +.Образование ненасыщенных жирных кислот. Элонгация жирных кислот. В отличие от растительных тканей ткани животных обладают весьма ограниченной способностью превращать насыщенные жирные кислоты в ненасыщенные.Установлено, что две наиболее распространенные мононенасыщенные жирные кислоты – пальмитоолеиновая и олеиновая – синтезируются из пальмитиновой и стеариновой кислот.Эти превращения протекают в микросомах клеток печени и жировой ткани при участии молекулярного кислорода, восстановленной системы пиридиновых нуклеотидов и цитохрома b5. Превращению подвергаются только активированные формы пальмитиновой и стеариновой кислот. Ферменты, участвующие в этих превращениях, получили название деса-тураз.Наряду с десатурацией жирных кислот (образование двойных связей) в микросомах происходит и их удлинение (элонгация), причем оба эти процесса могут сочетаться и повторяться. Удлинение цепи жирной кислоты происходит путем последовательного присоединения к соответствующему ацил-КоА двууглеродных фрагментов при участии малонил-КоА и НАДФН. Энзиматическая система, катализирующая удлинение жирных кислот, получила название элонгазы. На схеме представлены пути превращения пальмитиновой кислоты в реакциях десатурации и элонгации.
10.Световая стадия фотосинтеза: ЭТЦ хлоропластов.
Организация электрон-транспортной цепи хлоропластов. Общая характеристика "Z"-схемы фотосинтеза. Участие двух фотохимических реакций в фотосинтезе растений. Эффекты Эмерсона, Блинкса. Химическая природа основных компонентов электрон-транспортной цепи (ЭТЦ), последовательность их взаимодействия. Локализация ЭТЦ в мембране.Структурно-функциональная организация ФС I и ФС II. Основные пептиды комплексов, их расположение в мембране, локализация пигментов и редокс агентов. Гетерогенность фотосистем.Комплекс ФС I. Механизм образования в хлоропластах веществ с высоким восстановительным потенциалом; основные пути использования восстановительного потенциала в конструктивных и фоторегуляторных процессах. Энзиматические системы, участвующие в генерации восстановительного потенциала, их гетерогенность. Ферредоксины; основные физико-химические свойства и роль в восстановительных реакциях фотосинтеза. ФД-НАДФ-редуктаза; основные формы и функции фермента.Комплекс ФС II. Участие ФС II в процессе окисления воды. Современные представления о механизме фотоокисления воды; кинетика и химизм реакций. Структура Mn-содержащего комплекса. Фотоингибирование ФС II. Возможные пути фотодеструкции комплекса ФС II; включение защитных механизмов. Ингибиторный и флуоресцентный анализы как методы исследования акцепторной зоны ФС II; механизм действия гербицидов.Хиноны хлоропластов. Основные группы хинонов, их химическая структура, физиологическая роль. Пул пластохинонов, основные функции.Цитохромы хлоропластов. Цитохром b6/f-комплекс, его организация и функционирование в ЭТЦ. Окисление пластохинолов в реакциях Q-цикла; участие в сопряжении редокс-энергии с образованием трансмембранного электрохимического градиента протонов. Кинетика работы Q-цикла; механизмы, контролирующие скорость работы цикла. Участие цитохромного комплекса в реакциях циклического транспорта электронов. Система цитохрома b559. Основные редокс-формы, их взаимообратимость, функциональное значение.Пластоцианин. Молекулярная структура, механизм взаимодействия с цитохромным комплексом и ФС I.Основные принципы моделирования ЭТЦ. Ингибиторы транспорта электронов, локализация их центров действия. Искусственные электрон-акцепторные и электрон-донорные системы, используемые при моделировании различных участков ЭТЦ.Кинетические закономерности работы цепи. Соотношение двух фотосистем, механизмы их координированного взаимодействия. Долговременные и кратковременные механизмы адаптации тилакоидных систем к условиям освещенности. Циклические и нециклические потоки электронов. Основные механизмы и скорость переноса электронов на отдельных участках цепи. Система регуляции электронных потоков;.основные регуляторные центры; влияние конформационно-активных факторов и редокс-агентов. Взаимодействие компонентов ЭТЦ с кислородом. Фотосинтетическое фосфорилирование. Характеристика основных типов фотофосфорилирования. Циклическое и нециклическое фотофосфорилирование; физиологическая роль, пути транспорта электронов, механизмы регуляции. Механизм фотофосфорилирования. Основные положения хемиосмотической теории Митчела. Механизм и кинетика формирования градиента электрохимического потенциала ионов водорода; электрогенные и протолитические реакции хлоропластов. Сопрягающий комплекс хлоропластов. Структурно-функциональная организация и взаимодействие субъединиц CFо и CF1. Конформационная гипотеза сопряжения Бойера и ее развитие в работах последних лет. Ротационный механизм работы АТФ-синтазы. Работа каталитического центра CF1. Изменения энергии связывания нуклеотидов в каталитических центрах CF1 как основа образования АТФ в процессе фотофосфорилирования. АТФазная функция CFo-CF1 комплекса, ее физиологическая роль. Активация CFo-CF1 комплекса.
12.Фотосинтез: цикл Кальвина и Хэтча-Слейка.
В цикл вовлекаются АТФ и НАДФ·Н, образованные в ЭТЦ фотосинтеза, углекислый газ и вода; основным продуктом являеся глицеральдегид-3-фосфат. Поскольку АТФ и НАДФ·Н могут образовываться в разных метаболических путях, цикл не следует рассматривать строго привязанным к световой фазе фотосинтеза.Общий баланс реакций цикла можно представить уравнением:
3 CO2 + 6 НАДФ·Н + 5 H2O + 9 АТФ → C3H5O3-PO3 + 3 H+ + 6 НАДФ+ + 9 АДФ + 8 Фн + 3 H2O
Две молекулы глицеральдегид-3-фосфата используются для синтеза глюкозы.
Цикл состоит из трёх стадий: на первой под действием фермента рибулозобисфосфат-карбоксилаза/оксигеназа происходит присоединение CO2 к рибулозо-1,5-дифосфату и расщепление полученной гексозы на две молекулы 3-фосфоглицериновой кислоты (3-ФГК). На второй 3-ФГК восстанавливается до глицеральдегид-3-фосфата (фосфоглицеральдегида, ФГА), часть молекул которого выходит из цикла для синтеза глюкозы, а другая часть используется в третьей стадии для регенерации рибулозо-1,5-дифосфата.
КарбоксилированиеКарбоксилирование рибулозо-1,5-бисфосфата (5-углеродное соединение) осуществляется рубиско в несколько стадий. На первой кетонная группа рибулозы восстанавливается до спиртовой, между 2 и 3 атомами углерода устанавливается двойная связь. Полученное соединение нестабильно и именно оно карбоксилируется с образованием 2-карбокси-3-кето-D-арабитол-1,5-бисфосфата. Его структурный аналог 2-карбокси-D-арабитол-1,5-бисфосфат ингибирует весь процесс. Новое, уже 6-углеродное соединение, также нестабильно и распадается на две молекулы 3-фосфоглицериновой кислоты (3-фосфоглицерат, 3-ФГА).
ВосстановлениеВосстановление 3-фосфоглицериновой кислоты (3-ФГА) происходит в две реакции.Сначала каждая 3-ФГА с помощью 3-фосфоглицераткиназы и с затратой одной АТФ фосфорилируется, образуя 1,3-бисфосфоглицериновая кислота (глицерат-1,3-бисфосфат).
Затем под действием глицеральдегид-1,3-фосфатдегидрогеназы бисфосфоглицериновая кислота восстанавливается НАД(Ф)·H (у растений и цианобактерий; у пурпурных и зелёных бактерий восстановителем является НАД·H) параллельно с отщеплением одного остатка фосфорной кислоты. Образуется глицеральдегид-3-фосфат (фосфоглицеральдегид, ФГА, триозофосфат). Обе реакции обратимы.
Date: 2015-09-24; view: 769; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |