
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Взаимодействие металлов со щелочами
Со щелочами взаимодействуют амфотерные металлы, относящиеся в основном ко 2-й группе (Zn, Be, Al, Sn, Pb и др.). Реакция протекает сплавлением металлов со щелочью:
Pb+2NaOH=Na2PbO2 +Н2;
Pb0 – 2 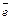 =Pb2+ | 1;
=Pb2+ | 1;
2Н++2 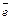 =Н2° | 1
=Н2° | 1
или при взаимодействии с крепким раствором щелочи:
Be + 2NaOH + 2H2О = Na2[Be(OH)4] + H2;
Ве° – 2 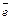 =Ве+2 | 1;
=Ве+2 | 1;
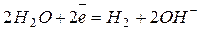 | 1.
| 1.
Амфотерные металлы образуют амфотерные оксиды и соответственно амфотерные гидроксиды (взаимодействующие с кислотами и щелочами с образованием соли и воды), например:
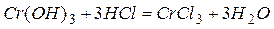
или в ионной форме: 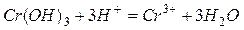 ;
;
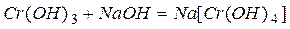
или в ионной форме: 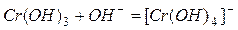 .
.
Практическая часть
Опыт№ 1. Взаимодействие металлов с водой
Возьмите небольшой кусочек щелочного или щелочноземельного металла (натрий, калий, литий, кальций), который хранится в банке с керосином, тщательно осушите его фильтровальной бумагой, внесите в фарфоровую чашку, заполненную водой. По окончании опыта добавьте несколько капель фенолфталеина и определите среду образовавшегося раствора. При взаимодействии магния с водой реакционную пробирку подогрейте некоторое время на спиртовке.
Опыт№2. Взаимодействие металлов с разбавленными кислотами
В три пробирки налейте по 20–25 капель 2н раствора соляной, серной и азотной кислот. В каждую пробирку опустите металлы в виде проволоки, кусочков или стружки. Наблюдайте происходящие явления. Пробирки, в которых ничего не происходит, подогрейте на спиртовке до начала реакции. Пробирку с азотной кислотой осторожно понюхайте для определения выделяющегося газа.
Опыт №3. Взаимодействие металлов с концентрированными кислотами
В две пробирки налейте по 20–25 капель концентрированной азотной и серной (осторожно!) кислот, опустите в них металл, наблюдайте происходящее. В случае необходимости пробирки можно подогреть на спиртовке до начала реакции. Для определения выделяющихся газов пробирки осторожно понюхайте.
Опыт№4. Взаимодействие металлов со щелочами
В пробирку налейте 20–30 капель концентрированного раствора щелочи (КОН или NaOH), внесите металл. Пробирку слегка подогрейте. Наблюдайте происходящее.
Опыт№5. Получение и свойства гидроксидов металлов
В пробирку налейте 15–20 капель соли соответствующего металла, добавьте щелочь до выпадения осадка. Осадок разделите на две части. К одной части прилейте раствор соляной кислоты, а к другой – раствор щелочи. Отметьте наблюдения, напишите уравнения в молекулярной, полной ионной и краткой ионной формах, сделайте вывод о характере полученного гидроксида.
Оформление работы и выводы
К окислительно-восстановительным реакциям напишите уравнения электронно-ионного баланса, ионообменные реакции напишите в молекулярной и ионно-молекулярной формах.
В выводах напишите, к какой группе активности (1, 2 или 3-й) относится изученный вами металл и какие свойства (основные или амфотерные) проявляет его гидроксид. Выводы обоснуйте.
Лабораторная работа № 11
Date: 2015-09-24; view: 5272; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |