
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Общая характеристика
Вещества природного происхождения часто представляют собой гетерофункциональные соединения, в молекулах которых имеются различные функциональные группы. В роли таких групп чаще выступают гидроксильная, карбонильная, карбоксильная. Гетерофункциональные соединения, наряду с полифункциональными, играют важную роль в биологических процессах и часто представляют собой действующее начало лекарственных средств.
В первом приближении химические свойства гетерофункциональных соединений представляют собой сумму свойств, обусловленных каждой группой в отдельности. Однако во многих случаях наличие двух (или более) различных функциональных групп приводит к усилению или ослаблению свойств, присущих монофункциональным соединениям, и, что более важно, вызывает появление специфических химических свойств, присущих только гетерофункциональным соединениям.
Гидроксикислотами называются соединения, в молекулах которых содержатся гидроксильная и карбоксильная группы.
Эти функциональные группы могут быть присоединены к алифатической цепи (алифатические гидроксикислоты) или к ароматическому кольцу, в последнем случае используют иногда родовое название фенолокислоты.
Число карбоксильных групп определяет основность гидроксикарбоновых кислот, а суммарное число групп ОН (как спиртовых, так и карбоксильных) – их атомность. Так, например, молочная кислота СН3СНОН―СООН является одноосновной двухатомной кислотой, яблочная НООС―СНОН―СН2―СООН - двухосновной трехатомной и винная НООС―СНОН―СНОН―СООН - двухосновной четырехатомной.
По взаимному расположению фунцкциональных групп различают α-, β-, γ-, δ-гидроксикислоты и т.д. Буквы греческого алфавита указывают положение гидроксильной группы относительно карбоксильной, причем отсчет ведется от ближайшего к карбоксильной группе атома углерода, т.е. от атома С-2. Следует обратить внимание на то, что в заместительной номенклатуре ИЮПАК для замещенных карбоновых кислот локанты α-, β-, γ- и т.д. не употребляются.
Систематические названия гидроксикислот строятся по общим принципам заместительной номенклатуры.
По систематической номенклатуре названия гидроксикислот производят от названий карбоновых кислот, причем к этому названию прибавляется характерная для спирта приставка гидрокси-. Нумерацию обычно начинают от карбоксильной группы. Так, например, молочная кислота может быть названа 2-гидроксипропановой кислотой.
1.1. Некоторые биогенные гидроксикарбоновые кислоты
| Формула | Тривиальное название кислоты | Название солей и сложных эфиров |
 2-гидроксипропановая
кислота
2-гидроксипропановая
кислота
| Молочная | Лактаты |
 гидроксибутандиовая
кислота
гидроксибутандиовая
кислота
| Яблочная | Малаты |
 2,3-дигидроксибутандиовая кислота
2,3-дигидроксибутандиовая кислота
| Винная | Тартраты |
| Продолжение | ||
 2-гидроксипропан-1,2,3-трикарбоновая
кислота
2-гидроксипропан-1,2,3-трикарбоновая
кислота
| Лимонная | Цитраты |
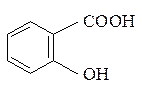 2-гидроксибензойная кислота
2-гидроксибензойная кислота
| Салициловая | Салицилаты |
| Примечание: Звёздочкой отмечены хиральные центры, т.е. асимметрические углеродные атомы |
Гомологический ряд одноосновных гидроксикислот начинается гидроксимуравьиной или угольной кислотой. Затем идет гликолевая, или гидроксиуксусная кислота СН2ОН―СООН. Эти две кислоты не имеют структурных изомеров. Следующий гомолог может существовать в виде двух изомеров, отличающихся по положению гидроксильной группы: молочная и β-гидроксипропионовая кислоты. Кислота с четырьмя углеродными атомами может существовать в виде пяти структурных изомеров. Три из них можно рассматривать как производные нормальной масляной кислоты; они являются изомерами по положению ОН группы:
| СН3―СН2―СНОН―СООН | α-гидроксимасляная кислота, 2-гидроксибутановая кислота |
| СН3―СНОН―СН2―СООН | β-гидроксимасляная кислота, 3-гидроксибутановая кислота |
| СН2ОН―СН2―СН2―СООН | γ-гидроксимасляная кислота, 4-гидроксибутановая кислота |
Два других изомера – производные изомасляной кислоты и, следовательно, отличаются от первых строением углеродного скелета:

| α-гидроксиизомасляная кислота, 2-метил-2-гидроксипропановая кислота |

| β-гидроксиизомасляная кислота, 2-метил-3-гидроксипропановая кислота |
Однако для ряда широко распространенных представителей гидроксикислот предпочтительными являются тривиальные названия.
Для гидроксикислот очень часто наблюдается также оптическая изомерия, связанная с наличием асимметрических углеродных атомов.
Многие гидроксикислоты, например молочная, яблочная, винная, изолимонная, имеют в молекуле хиральные центры. Так, молочная кислота существует в трех формах: две оптически активные, т.е. энантиомеры (зеркальные изомеры), а третья – оптическая неактивная, являющаяся рацемической смесью энантиомеров. Молочная кислота, выделенная из мышечной ткани, является L-энантиомером. D-молочная кислота образуется из сахаров при помощи особых бактерий-возбудителей брожения. Под действием молочнокислых бактерий образующаяся молочная кислота является рацемической смесью обоих энантиомеров и не проявляет оптической активности:

Яблочная кислота подобно молочной также существует в трех формах: D-энантиомер, L-энантиомер и их D,L-рацемат.
На примере стереоизомеров яблочной кислоты П.Вальден (1896) впервые показал возможность взаимопревращений энантиомеров.
Дальнейшие превращения D(+)-яблочной кислоты в L(-)-яблочную кислоту показаны на схеме:

Действие пентахлорида фосфора на L-яблочную кислоту протекает с обращением конфигурации асимметрического центра по механизму S N 2 и приводит к образованию D-хлорянтарной кислоты. Последняя при обработке влажным оксидом серебра (условно – AgOH) превращается в D-яблочную кислоту без обращения конфигурации (строго говоря, здесь обращение происходит дважды, но конечным результатом является сохранение конфигурации).
Впоследствии превращения, протекающие с изменением конфигурации асимметрического центра, стали называться вальденновским обращением. Изучение именно этого явления послужило, наряду с кинетическими исследованиями, фундаментом для создания теории реакций нуклеофильного замещения у насыщенного атома углерода.
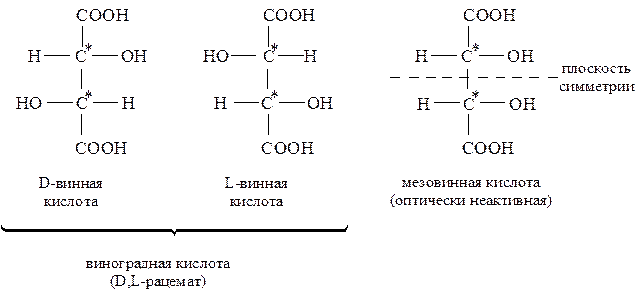
Молекула винной кислоты содержит два одинаковых хиральных центра, между которыми может проходить плоскость симметрии этой молекулы. Поэтому винная кислота в природе существует в четырех формах: D-винная, L-винная, D,L-рацемат, называемый виноградной кислотой, а также мезовинная кислота, являющаяся оптически неактивным стереоизомером вследствие внутримолекулярной компенсации из-за симметричности ее структуры. Оптические изомеры гидроксикислот отличаются не только физическими свойствами, но и тем, что их биологические и физиологические функции различны. В организме обычно присутствует один стереоизомер гидроксикислоты.
Рассмотрим способы получения и свойства одноосновных двухатомных гидроксикислот. Начнем с наиболее простых гидроксикислот, опустив угольную кислоту, так как по свойствам эта кислота и её производные сильно отличаются от других гомологов.
Date: 2015-09-23; view: 1453; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |