
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Покажите вывод константы равновесия на основе равенства скоростей прямой и обратной реакции
Постройте график распределение молекул по энергии максвелла-Больцмана и покажите как влияет температура на понижение кривых распределений.
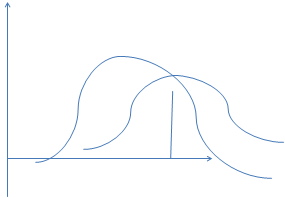 |
Расскажите о физическом смысле активного комплекса и о его роли в снижении энергии активации химической реакции.
ОТВЕТ: Физический смысл (2.70) ясен — скорость реакции в общем случае определяется не только теплотой активации, но и изменением свободной энергии при переходе в активированное состояние, причем эти факторы противоположны по своему действию. Если переход в активированное состояние ведет к сильному увеличению энтропии, то реакция будет идти с большой скоростью несмотря на высокие значения энергии активации. И напротив, если возрастание энтропии невелико, то даже при низких значениях ДН (или ди) реакция будет протекать медленно.
Химическое равновесие.
Покажите вывод константы равновесия на основе равенства скоростей прямой и обратной реакции.
ОТВЕТ: Концентрационные зависимости скоростей прямой и обратной реакций определяются следующими выражениями закон действующих масс для скоростей реакций  ДЛЯ ПРЯМОЙ И ДЛЯ ОБРАТНОЙ
ДЛЯ ПРЯМОЙ И ДЛЯ ОБРАТНОЙ 
2. От каких внешних параметров зависит константа равновесия, а от каких не зависит?
ОТВЕТ:
а) Изменение концентрации хотя бы одного из компонентов системы;
б) Изменение давления в системе;
в) Изменение объема системы;
г) Изменение температуры системы. Повышение температуры сместит равновесие влево, понижение - вправо.
Повышение давления - влево, понижение - вправо
Повышение концентраций исходных веществ - вправо, понижение влево.
Повышение концентраций продуктов - влево, понижение – вправо. Следовательно, константа равновесия не зависит от пути реакции (стадийности процесса) величина равновесия не зависит от тех концентраций исходных веществ и продуктов реакции, которые устанавливаются в равновесной системе
3. Почему стехиометрические коэффициенты химической реакции автоматически переносятся в выражение константы равновесия?
ОТВЕТ: Следует учитывать, что независимо от пути реакционного процесса кол его стадий стехиометрические коэффициенты реакции автоматически переходят в показатели автоматически переходят в показатели степени выражения константы равновесия. это следствие того факта что константа равновесия является термодинамической величиной, а от сюда равновесные концентрации не зависят от механизма реакции, а определяются только равномерным состоянием системы.
4. Почему в выражении константы равновесия не входят концентрации твёрдых и чистых жидких веществ?
ОТВЕТ: Концентрации чистых твёрдых веществ и чистых жидкостей не включается в выражение для константы равновесия (они входят в неё неявным образом как постоянные величины)
Date: 2015-09-22; view: 871; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |