
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Неорганические остатки
С проблемой недостаточного распада отходов приходится сталкиваться в случае веществ не только органического, но и неорганического происхождения. В первую очередь это обнаруживается при загрязнении воды хлоридами, минеральными удобрениями, соединениями тяжёлых металлов и кислотами. К тому же некоторые вещества, например тяжёлые металлы, даже после их извлечения из первоначальных соединений сохраняют свою токсичность.
И о н ы, п о с т у п а ю щ и е и з у д о б р е н и й и с о л е й, и с п о л ь з у е м ы х д л я с н е г о т а я н и я п р и у б о р к е с н е г а и л ь д а. Для таяния льда, как правило, используют поваренную соль, которая в широком диапазоне концентраций нетоксична для большинства живых существ. Но, благодаря высокому осмотическому давлению, проявляющемуся при концентрации солей, достигающей несколько сот мг на литр, может нарушаться нормальное функционирование осмотических систем в пресной воде. Только некоторые виды живых существ имеют такую подвижную систему осмотического регулирования, что они безболезненно переносят большие перепады осмотического давления, например, могут перемещаться из морской воды в пресную речную и обратно.
Обычно пресная вода содержит 2 – 10 мг хлоридов на литр. Морская вода содержит значительно больше солей. В Северном море содержание хлоридов составляет около 19000 мг/л. Некоторые реки в настоящее время так загрязнены солями, что это вызывает глубокие экологические изменения. К главным источникам загрязнений в этом случае относятся сточные воды соляных рудников, а также потоки солёной воды на улицах и автострадах в зимнее время. В то время как воды соляных разработок постоянно сохраняют высокую концентрацию солей, зимние потоки на улицах и выбросы солей в водоёмы носят сезонный характер.
Содержание хлоридов в воде определяет и её пригодность для питья. Для питьевой воды предельное значение составляет 200 мг/л. Вода с большим содержанием либо солона, либо горька на вкус. Содержание хлоридов в воде также определяет возможность её использования в сельском хозяйстве, в том числе для парников и оранжерей. В зависимости от вида растений предельная концентрация хлоридов составляет 50 – 300 мг/л.
Совсем иначе, чем хлориды, на воду действуют удобрения. Обычно хорошо растворимые в воде удобрения вымываются обильными дождями, попадая в грунтовые воды и поверхностные воды (водоёмы). В наиболее распространённых удобрениях ионы К+ и Са2+ можно считать безвредными, так как их концентрации в природной воде (грунтовых водах и водах водоёмов) не опасны для живых существ и не наносят ущерба природной среде.
Напротив, ионы NO-3, NH+4, H2PO-4 и HPO2-4 способствуют зарастанию водоёмов растительностью. Уже 10 мг фосфата на 1 м3 воды приводят к заметному росту растительности, вызывая разрастание планктона.
Наряду с удобрениями источником фосфатов служат и моющие средства. Нитраты и фосфаты попадают в воду также в результате микробиологического разрушения органических отходов.
При высоких значениях рН фосфаты выпадают в виде солей кальция и железа, что снижает эффект зарастания водоёмов. При создании в воде анаэробной среды и росте содержания восстановителей в результате процессов брожения выпавший в осадок фосфат железа (III) восстанавливается до фосфата железа (II), после чего зарастание водоёмов вновь усиливается.
Растворимые соединения азота не только способствуют зарастанию водоёмов, попадая в питьевую воду, они могут оказывать токсическое действие на людей. Проникая вместе с пищей в слюну и тонкие кишки, нитраты микробиологически восстанавливаются до нитритов, в результате в крови образуется нитрозил-ионы:
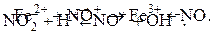 |
Нитрозил-ионы могут окислять железо (II) в гемоглобине до железа (III), что препятствует связыванию кислорода гемоглобином при образовании координационной связи между Fe и кислородом:
В результате возникают симптомы кислородной недостаточности, приводящей к цианозу (синюхе). При переходе 60-80% железа (II) гемоглобина в железо (III) наступает смерть. Особенно чутко на нитрозил-ион реагируют грудные младенцы в первые недели своей жизни. У них недостаточно проявляется деятельность гемоглобинредуктазы, восстанавливающей железо (III) в железо (II). У взрослых этот процесс идёт активнее, и в результате организм не так остро реагирует на присутствие нитратов и нитритов. Тем не менее и взрослые должны избегать чрезмерных количеств нитратов и нитритов. Нитриты расширяют сосуды и образуют в кислой среде желудка азотистую кислоту, обладающую мутагенным действием. Кроме того, нитриты в кислой среде образуют в желудке вместе с органическими аминами из растительной и животной пищи нитрозамины, также обладающие мутагенным действием.
Т я ж ё л ы е м е т а л л ы. К числу важнейших факторов, обусловливающих загрязнение воды, относятся тяжёлые металлы. Попадание в воду тяжёлых металлов связано с деятельностью целого ряда отраслей промышленности (табл. 20).
Таблица 20
Отрасли промышленности,
загрязняющие природную среду тяжёлыми металлами
| Название отрасли | Cd | Cr | Cu | Hg | Pb | Ni | Sn | Zn |
| Целлюлозно-бумажная промышленность Горно-добывающая промышленность Производство хлора и щелочей Производство удобрений Очистка нефти Производство стали Цветная металлургия Авто- и авиастроение Стекло, цемент, керамика Текстильная промышленность Кожевенная промышленность Паросиловые установки | + + + + + + | + + + + + + + + + + + + | + + + + + + | + + + + + + + | + + + + + + + + | + + + + | + + + + | + + + + + + + + + |
Поскольку тяжёлые металлы содержатся также и в бытовых отходах, существует опасность, что они могут попадать из свалок в грунтовые воды и водоёмы. Должно быть категорически запрещено использование соединений, содержащих тяжёлые металлы, ещё в 1970-е годы применявшихся для защиты растений и лесов.
Попавшие в воду соединения тяжёлых металлов сравнительно быстро распространяются по большому объёму. Частично они выпадают в осадок в виде карбонатов, сульфатов или сульфидов, частично адсорбируются на минеральных или органических осадках. Поэтому содержание тяжёлых металлов в отложениях постоянно растёт. Многочисленные наблюдения показали, что содержание тяжёлых металлов в донных осадках рек и морей в 1000 – 10000 раз превышает их содержание в воде. Особенно напряжённая ситуация может возникнуть, если адсорбционная способность осадков будет исчерпана. Необходимое для этого время нельзя установить с точностью, однако, когда будет достигнута адсорбционная ёмкость, тяжёлые металлы начнут поступать в воду. Но ещё задолго до наступления насыщения тяжёлые металлы из отложений могут переходить в воду, оказывая вредоносное воздействие на окружающую среду. Частично этот процесс наблюдается в половодье, например, при таянии снегов, когда бурные потоки воды уносят донные отложения. Если рН воды значительно меньше 7, то осаждённые тяжёлые металлы могут перейти в воду. Значение рН уменьшается при попадании кислот в реки и в сильно заросшие водоёмы, когда в результате активной деятельности растущих микроорганизмов выделяется особенно много СО2. При переходе металлов в воду известную роль играет, кроме того, образование хелатов с ионами этилендиаминтетраацетата и нитрилтриацетата, которые содержатся в очищающих препаратах и моющих средствах.
Наряду с этими давно известными путями попадания в воду тяжёлых металлов обнаружены реакции, в результате которых тяжёлые металлы становятся растворимыми в воде либо в липидах (маслах и жирах), проникая затем в организм и включаясь в цикл питания.
Для ртути и олова было обнаружено, что в морских анаэробных условиях, т.е. в отложениях отмерших водорослей, они, присоединяя водород, переходят в летучие соединения. Такого рода гидрирование может осуществляться и с другими тяжёлыми металлами. Эти реакции показывают, что на отдельных участках моря, покрытых обильной растительностью, покров из водорослей не только угрожает морским обитателям, но и повышает «активность» тяжёлых металлов, переводя их в форму летучих гидридов, в которой они покидают воду.
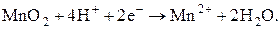 |
Марганец при окислении выпадает в виде нерастворимого MnO2, который в анаэробных условиях, вероятно с помощью микроорганизмов переходит в растворимый в воде ион Mn2+:
Хотя марганец и относится к числу жизненно необходимых элементов, однако, лишь при следовых его концентрациях в организме он может участвовать в качестве переносчика в окислительно-восстановительных реакциях. При высоких концентрациях этот элемент токсичен.
Для некоторых тяжёлых металлов установлена возможность микробиологического алкилирования, таким образом, они могут включаться в цикл питания; метилирование характерно для мышьяка и ртути. У мышьяка наблюдается переход арсената в арсенит, а затем, при метилировании, в метилмышьяковую и диметилмышьяковую кислоту. В аэробных условиях образуется триметиларсин, а анаэробных – диметиларсин.
В случае олова, при участии микробов возможно метилирование соединений олова(IV) с образованием диметил- и триметилоловохлоридов. Металлическая ртуть может метилироваться в две стадии:
 |
Как ионы метилртути, так и диметилртуть сорбируются организмом.
Совсем другой путь для попадания в цепь питания обнаружен у кадмия и некоторых других тяжёлых металлов. Кадмий может замещать цинк в цинксодержащих ферментах (гидроксилазах). После этого фермент становится негативным, а организмы, в которые попал кадмий, могут служить пищей для других организмов. Таким образом, Cd внедряется в общую цепь питания.
Экологическое значение тяжёлых металлов или других устойчивых токсинов в цепи питания можно продемонстрировать на примере ртути – первого металла, для которого было обнаружено биоконцентрирование.
В 1953 г. в Японии у 121 жителя побережья в бухте Минамата было обнаружено заболевание, сопровождавшееся ломотой в суставах, нарушением слуха и зрения. Это заболевание, вошедшее в литературу под названием «болезнь Минамата», закончилось смертью почти для трети больных. Интенсивное расследование позволило установить, что на ацетиленовом производстве ртутные отходы сбрасывались в реку, впадающую в бухту Минамата. Ртуть, о чём первоначально и не подозревали, микробиологическим путём превращалась в метилртуть, которая через планктон, моллюсков и рыб постепенно концентрировалась и в конце цепи, дойдя до человека, достигла токсичной концентрации. Такого рода кумуляция возможна только тогда, когда токсин поступает в организм быстрее, чем выводится из организма.
Подобные вещества представляют особую опасность для организма вследствие их устойчивости и липофильности (взаимодействию с жирами), обусловливающими большой период полувыведения, т.е. время, в течение которого выделяется или разрушается половина усвоенного организмом вещества. Биологический период полувыведения ртути велик, он составляет для большинства тканей организма человека 70 – 80 дней. Для кадмия период полувыведения составляет более 10 лет, поэтому даже следам кадмия, если они систематически попадают в организм, надо уделять самое серьёзное внимание. Не приходится удивляться вредным последствиям внедрения кадмия в организм: соответствующая болезнь носит название итаи-итаи, выражается в болезненном скручивании костей, анемии и почечной недостаточности. Токсичность тяжёлых металлов связана с взаимодействием хелатов и сульфидов с биологически активными веществами, особенно с ферментами.
Несмотря на единообразные первичные условия протекания биохимических процессов различные тяжёлые металлы оказывают разное действие на организм, вызывая те или иные симптомы заболеваний, что в первую очередь связано с различиями в характере распределения отдельных металлов в организме. При этом избирательно повреждаются различные органы и ткани. Так, например, кадмий преимущественно отлагается в костях, метилртуть – в клетках центральной нервной системы, хром (VI) блокирует многие ферменты печени. Наряду с этими предпочтительными органами воздействия присутствие тяжёлых металлов можно установить и во многих других тканях.
У растений устойчивость к действию тяжёлых металлов выше, чем у людей и животных. В растениях тяжёлые металлы могут отлагаться в клеточных стенках (целлюлоза) или в клеточных вакуолях с образованием хелатов. В этих случаях тяжёлые металлы становятся физиологически неактивными. Поэтому необходимо обращать особое внимание на содержание тяжёлых металлов в растениях, употребляемых в пищу. Растения могут нормально развиваться благодаря их специфическому механизму обеззараживания, и даже при таких концентрациях тяжёлых металлов, которые для человека являются токсичными.
К и с л о т н ы е в ы б р о с ы и г и б е л ь р ы б. Внутренние водные пути, а также некоторые районы Северного моря и Атлантики в течение многих лет испытывают действие антропогенных кислотных выбросов. Важным компонентом этих загрязнений являются так называемые «слабые» кислоты, под которыми подразумевают очень разбавленные кислоты, получающиеся из отходов производств органических соединений и титанового производства (получение титана или диоксида титана из руды, содержащей ильменит FeTiO3). Кислый раствор, образующийся при получении TiO2, содержит около 2% серной кислоты, загрязнённой сульфатом железа, а также рядом тяжёлых металлов. Сброс разбавленных кислот приводит к кислотному отравлению рыб и планктона и к возможности попадания токсинов в цепи питания.
Для внутренних водоёмов наибольшую опасность представляют кислотные дожди. К тому же известную роль могут сыграть кислоты почв, особенно если в водоёмы попадают воды из почв, содержащих сырой гумус. Заметные изменения рН отмечаются в водах, поступающих от основных (магматических) пород кислотного характера. В то время как в среднеевропейских странах образование кислотных осадков идёт главным образом за счёт выбросов SO2, в США в этом процессе главную роль играют азотистая и азотная кислоты, которые образуются при выбросах NOx.
В реках и озёрах Южной Норвегии уже в 1970-х гг. была отмечена массовая гибель пресноводных рыб, так как значение рН в водоёмах снизилось с 6 до 4,7. Критическое положение создавалось в весенний период, когда с талыми водами в реки и озёра хлынули после накопления и концентрирования кислых выбросов потоки кислых вод.
На закисленные воды болезненно реагируют раковидные моллюски. Если значение рН падает ниже 5,2, то Са2+-обмен у них настолько нарушается, что им грозит гибель. При этих значениях рН раковины медленно разрушаются. Несмотря на несколько большую сопротивляемость, рыбы также страдают при понижении рН. Для последних предельное значение рН составляет 5 – 4,5, в зависимости от вида рыбы. Так, например, речная форель оказалась довольно устойчивой к действию кислот, в то время как карп попал в разряд высокочувствительных пород. Водоросли и другие представители планктона гибнут при тех же значениях рН, что и рыбы. У рыб и планктона, как и раковидных, при низких значениях рН в первую очередь нарушается Са2+-обмен. Это отражается как на росте костей животных, так и на свойствах икры. У водорослей нарушение обмена веществ в первую очередь сказывается на образовании оболочек клеток, их делении, а также на протекании процесса фотосинтеза. Для рыб вблизи нижней границы критической области рН ионный обмен определяет состояние жабер. Содержание NaCl в крови уменьшается, при этом понижается и осмотическое давление. При значении рН меньше 4,5 из силикатов выщелачиваются ионы Al3+, которые вызывают некрозы (разрушение) тканей организма рыб и их гибель.
Date: 2015-09-27; view: 675; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |