
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Оксиды азота
Если количество оксидов азота от выбросов в атмосферу сравнить с содержанием оксидов азота (около 2 млрд. т) в воздухе, лишённом антропогенных выбросов, роль их в загрязнении воздуха представляется незначительной, тем более, что NO2 сохраняется в атмосфере лишь несколько дней. Таким образом, антропогенная доля оксидов азота в атмосфере не должна иметь большого значения для общего баланса. Однако по составу антропогенные выбросы NOx отличаются от природных оксидов азота, и этот состав характерен для густонаселённых регионов страны.
Природные загрязнения атмосферы оксидами азота связаны с электрическими разрядами, при которых образуется NO, а в последствии – NO2.. В очень небольших количествах NO2 может выделяться в процессе ферментации силоса. Основная часть оксидов азота перерабатывается в почве микроорганизмами, причём образуется N2O.
Микробиологические преобразования особенно успешно протекают в почвах с рН более 4,5, с плохой воздухопроницаемостью, но относительно богатых азотсодержащими удобрениями. Главным местом протекания этих процессов служат рисовые чеки, неделями залитые водой. При попадании нитратов на большую глубину в другие почвы, при ограниченном доступе кислорода, также усиливается микробиологическая денитрификация. Плотные почвы и почвы на обочинах дорог также обеднены кислородом. В цепи превращений NO-3 ® N2 избыток NO-3 препятствует превращению N2O в N2, способствуя высвобождению N2O в атмосферу. Опыты с удобрениями, содержащими 15N, показали, что песчаные почвы отдают от 11 до 25%, глинистые почвы – от 16 до 31%, болотные почвы – от 19 до 40% связанного азота удобрений в атмосферу вследствие денитрификации. Но главное количество N2O выделяют азотсодержащие соединения почв. При этом исходят из того, что выделяемые почвами соединения азота наполовину или более состоят из N2O. Оксиды азота антропогенного происхождения главным образом состоят из NO, образующегося при сгорании топлива, особенно если температура превышает 1000°С. Считается, что NO может быть окислён до NO2 также с помощью озона или с помощью пероксидных радикалов (НО*2). Оксиды азота также образуются в некоторых отраслях химической промышленности, при процессах нитрования, производстве суперфосфата, очистке металлов азотной кислотой, изготовлении взрывчатых веществ и плавке. Но главным источником выбросов оксидов азота всё же остаётся автомобильный транспорт.
Постоянный выброс оксидов азота за последние годы связан главным образом с развитием автотранспорта. Кроме того, тенденция к более полному использованию топлива также приводит к увеличению выбросов NOх, так как повышение эффективности работы мотора связано с ростом температуры. Растёт число выбросов и при увеличении скорости движения транспорта, причём нелинейно: количество NOх на автотрассах растёт также с увеличением скорости автомашин. Антропогенное загрязнение атмосферы оксидами азота принимает критический характер в густонаселённых городах, где чаще выпадают осадки. Наивысшие концентрации выбросов в городах достигают значений 800 – 1200 мкг/м3.
Для полного выяснения механизма окисления первично образованного NO в NO2 надо установить источники необходимых для этого процесса радикалов пероксида или соответственно тропосферного озона, концентрация которого составляет 10 – 100 млрд.-1. Источником тропосферного озона в незначительной степени является и стратосфера, но в основном он зарождается в тропосфере, причём схема процесса образования резко отличается от образования стратосферного озона. На начальных стадиях процесса решающую роль играет СО:
СО + ОН* ® Н* + СО2,
Н* + О2 + М ® НОО* + М,
где М – частицы, участвующие в столкновениях, но не вступающие в реакции, например N2. Образующийся при этом радикал пероксида водорода окисляет NO до NO2:
НОО* + NO ® ОН* + NO2.
Ночью NO2 стабилен. Днём под влиянием солнечного света (область длин волн менее 430 нм), как это происходит и вблизи от поверхности земли, NO2 фотолитически расщепляется на NO и кислород.
NO2 может участвовать в ряде других реакций. В присутствии пыли, содержащей щелочные и щелочноземельные металлы, идёт образование солей, при этом образуются менее токсичные продукты:
2NO2 + NаСО3 + Н2О ® NаNO2 + NаNO3 + Н2СО3.
Как дальнейшее ослабление токсичности следует рассматривать образование азотной кислоты во влажном воздухе, так как при этом ослабляется окислительная активность NO2, хотя азотная кислота и остаётся в клетках организма. Образующаяся одновременно азотистая кислота при больших концентрациях оказывает мутагенное действие
2NO2 + Н2О ® НNO2 + НNO3.
В небольших количествах NO2 может реагировать с радикалами ОН*, возникающими при фотолизе воды ультрафиолетовым светом, с образованием азотной кислоты:
NO2 + ОН* ® НNO3.
Поскольку все продукты приведённых выше реакций хорошо растворимы в воде, они легко вымываются дождевой водой из атмосферы, создавая кислотные осадки.
В слоях воздуха, близких к поверхности земли, озон вновь быстро реагирует с NO, образуя исходные продукты; таким образом, вскоре устанавливается равновесное состояние, которое препятствует накоплению О3. В выхлопных газах автомобильных двигателей при одновременном присутствии алканов и алкенов образуются органические радикалы, например:
R – H + O* ® R* + OH* или
R – H + OH* ® R* + H2O.
В дальнейшем озон вступает в реакции с углеводородами. Органические радикалы образуют в присутствии М и кислорода воздуха радикалы пероксидов:
R* + О2 + М ® RОО* + М,
которые в свою очередь окисляют NO в NO2
RОО* + NO ® NO2 + RО*.
Пероксирадикалы вступают в реакции полимеризации с олефинами, в которых образование цепи продолжается до тех пор, пока радикал или молекула NO не вызовет обрыва цепи. Наряду с полимеризацией пероксирадикалы могут реагировать с NO2. Из образующихся при этом соединений наиболее известен пероксиацетилнитрат (СН3СОО2NO2), сокращённо называемый в экологической химии ПАН, концентрация которого в смоге может достигать 50 млрд.-1. Поскольку это вещество очень легко вступает в реакцию взаимодействия с различными органическими соединениями, например ферментами, оно чрезвычайно токсично для человека и других живых существ. Наряду с ПАН из пероксидных соединений следует отметить различные альдегиды, которые также вносят в смог свою долю токсичности. Из-за высокой реакционной способности О3, ОН* и НОО* в смоге появляется множество различных соединений, которые не все известны. Состав смога зависит от его происхождения: переполненные автотранспортом города южной Европы (Афины, Мадрид) и Калифорнии (Лос-Анджелес) в солнечные летние месяцы страдают от смога лос-анджелесского типа, для которого характерно присутствие оксидов азота, озона, ПАН и других соединений пероксидного характера. В Средней Европе и Великобритании наблюдается смог лондонского типа (в осенний и зимний периоды), в нём преобладают SO2, H2SO4 и копоть. Кроме этих, крайних, представителей, возможно возникновение промежуточных видов смога различного состава и при различных погодных условиях.
Скорость образования озона зависит от освещённости, и поэтому его концентрация изменяется в течение суток. Уменьшение концентрации озона по ночам объясняется приостановлением его фотохимического синтеза, одновременно его концентрация понижается из-за продолжающегося окисления NO в NO2. В гористых местностях это изменение концентраций выражено менее резко, так как поступивший в течение дня в атмосферу озон ночью почти не расходуется на окисление NO (последний практически отсутствует в чистом горном воздухе).
Годовые изменения образования озона, вытекающие из суточных изменений, дают максимум в периоды интенсивной солнечной активности. Абсолютное количество фотохимически образованного озона зависит от интенсивности солнечного излучения и в районах с умеренным климатом, при характерной циклонной активности, может в различные годы значительно колебаться несмотря на сравнительно постоянную эмиссию.
Зависимость выхода О3 в реакциях его образования из NO и NO2 связана с суточными выбросами азота. С утра растёт концентрация NO в связи с ростом интенсивности движения транспорта; концентрация образующегося NO2 достигает максимума со смещением во времени на несколько часов, а ещё через некоторое время устанавливается максимальное содержание О3. При удалении от источников выбросов NO, т.е. от больших городов и промышленных центров, изменяется соотношение концентраций NO, NO2 и О3. По мере переноса выбросов от городов резко падает концентрация NO вследствие образования NO2. Концентрация NO2 меняется менее резко, так как убыль NO2 связана главным образом с естественными процессами. Концентрация О3 также очень сильно уменьшается вследствие реакции с NO. На большом удалении от источника выбросов в так называемых районах чистого воздуха всё же можно наблюдать сравнительно высокие концентрации О3. Это связано с фотохимическими превращениями NO2 в О3 на большой высоте, в то время как вблизи поверхности оставшийся О3 реагирует с остатками NO. Фотохимические превращения О3 большей частью происходят при переносе за черту города. Только при максимуме выбросов и в отсутствие ветра или при обратном его направлении в воздухе больших городов можно зарегистрировать концентрации 300 – 400 мкг О3 на 1 м3 воздуха; предельное значение также повышается в областях чистого воздуха до 180 мкг/м3. В загрязнении атмосферы областей чистого воздуха решающую роль, естественно, играют расстояние от источников выбросов и преобладающее направление ветров.
Д е й с т в и е NO2 и О3 н а о р г а н и з м ч е л о в е к а. Образующийся главным образом естественным путём N2O безвреден для человека, что позволяет использовать его для наркоза. Его роль в загрязнении воздуха заключается в том, что N2O при химических изменениях в стратосфере способствует разрушению озона.
Роль монооксида и диоксида азота надо оценивать совместно, так как в атмосфере эти газы встречаются только вместе. Поэтому говорят, как правило, только об активности оксидов азота или NOх, к тому же эти газы в дальнейшем приходят в равновесие с N2O3 и N2O4. Только вблизи от источника выбросов можно установить высокую концентрацию NO.
Монооксид азота не раздражает дыхательные пути, и поэтому человек может его не почувствовать. При вдыхании NO образует с гемоглобином нестойкое нитрозосоединение, которое быстро переходит в метгемоглобин, при этом Fe2+ переходит в Fe3+. Ион Fe3+ уже не может обратимо связывать О2. Концентрация метгемоглобина в крови 60 – 70% считается летальной. Но такое предельное значение может быть создано только в закрытом помещении, на открытом воздухе это невозможно.
По мере удаления от источника выброса всё большее количество NO переходит в NO2. Этот последний жёлто-коричневый газ особенно сильно раздражает слизистые оболочки. При контакте с влагой в организме образуется азотистая и азотная кислоты, которые разъедают стенки альвеол лёгких, подобно многим другим кислотам. При этом стенки альвеол и кровеносных капилляров становятся настолько проницаемы, что пропускают сыворотку крови в полость лёгких. В этой жидкости растворяется вдыхаемый воздух, образуя пену, препятствующую дальнейшему газообмену. Если своевременно не перекрыть доступ жидкости в альвеолы, то отёк лёгких может привести к смерти. Поскольку критические концентрации не могут быть достигнуты на открытом воздухе, а устанавливаются только в закрытых помещениях, то избежать этого можно, соблюдая надлежащие меры предосторожности. В промышленных районах и городах наблюдается концентрация NO2
0,4 – 0,8 мг/м3, при образовании смога – 1 мг/м3. Максимально допустимая эмиссионная концентрация (МЭК) составляет 9 мг/м3 (5 млн.-1).
Оксиды азота должны рассматриваться как вещества, представляющие серьёзную опасность для здоровья человека, даже когда фактическое содержание NOх в воздухе меньше МЭК. Нормы МЭК предназначены только для взрослого человека, кроме того, они не учитывают возможности комбинированного действия других вредных газов. При длительном действии оксидов азота, даже в концентрациях ниже МЭК, следует опасаться расширения клеток в корешках бронхов (тонкие разветвления воздушных путей альвеол), ухудшения сопротивляемости лёгких к бактериям, а также расширения альвеол.
Действие озона на организм подобно действию NO2, он также вызывает отёк лёгких. Кроме того, озон нарушает нормальное движение мерцательных волосков в бронхах, которые должны выводить чужеродные вещества из бронхов вместе с мокротой. Систематическое вдыхание озона приводит к накоплению в лёгких чужеродных веществ, что может привести к увеличению опасности заболевания раком, так как канцерогенные вещества задерживаются в лёгких дольше обычного. При концентрации О3 ниже значения МЭК около 0,2 мг/м3 (0,1 млн.-1) наблюдается усталость, головная боль, резь в глазах и раздражение слизистых оболочек. Если МЭК превышена, то может возникнуть тяжёлый отёк лёгких. Поэтому в городах, где существует опасность образования смога, концентрации О3 0,3 – 0,4 мг/м3 следует считать предельными. Обычно в промышленных районах концентрация озона в воздухе в летний период составляет около 0,03 мг/м3.
Б и о х и м и ч е с к о е в о з д е й с т в и е н а р а с т е н и я. Оксиды азота могут воздействовать на растения тремя путями: с помощью кислотных осадков, прямым контактом с растениями и косвенно путём фотохимического образования окислителей, таких, как О3 и ПАН. В форме кислотных осадков оксиды азота наносят ущерб растениям, увеличивая кислотность, как и в случае действия SO2. Прямой контакт растений с NOх можно сразу определить зрительно по пожелтению или побурению листьев и игл. Причиной такого изменения окраски является превращение хлорофиллов в феофитины и разрушение каротиноидов. Видимо, эти разрушения в результате окисления, как и в случае с SO2, вызываются гидропероксидными производными жирных кислот или радикалами жирных кислот. Окисление жирных кислот приводит, кроме того, к разрушению мембран и некрозу. Жирные кислоты могут окисляться и непосредственно при действии NO2, отнимающего от них водород с образованием ненасыщенной кислоты.
Образующаяся в клетках азотистая кислота оказывает мутагенное действие, при этом происходит окислительное дезаминирование нуклеиновой кислоты.
Нарушения роста растений при воздействии NO2 наблюдаются при концентрациях 0,35 мг/м3 (0,17 млн.-1) и выше. Растения более устойчивы (по сравнению с человеком) к воздействию чистого NO2 в первую очередь из-за особенностей усвоения NO2, который восстанавливается в хлоропластах и в качестве NН2-группы входит в аминокислоты. При концентрации NOх в два раза ниже предельной оксиды азота используются растениями в качестве удобрений.
Сравнивая границы токсичности оксидов азота с реальными концентрациями NOх в воздухе, можно видеть, что опасность повреждения растительности этими газами существует только в больших городах и промышленных районах. В то время как действие одного NO2 растения переносят в концентрациях до 0,35 мг/м3, то же количество NO2 в присутствии SO2 может причинить ущерб. Этот факт ясно показывает, что SO2 уже в очень малых концентрациях подавляет активность нитроредуктазы в хлоропластах. Таким образом, разрушительное действие NO2 усиливается в присутствии диоксида серы.
Озон значительно токсичнее оксидов азота при действии на растительность. Чувствительные виды растений уже после часовой обработки озоном при концентрации 0,05 – 0,1 мг/м3 проявляют признаки угнетения. Озон также изменяет структуру клеточных мембран. При этом сначала повышается проницаемость по отношению к воде, а затем к глюкозе. В результате этих процессов отмирают клетки мезофилла листьев, на поверхности образуются полости, в которых происходит полное отражение света. В этом случае говорят о появлении серебристой пятнистости листьев.
В клетке озон с помощью ароматических соединений образует радикалы ОН*, которые реагируют с глянцевым слоем кожицы листьев и игл, в результате чего на этом слое появляются трещины и он становится хрупким. В трещинах могут, например, прорастать грибные споры, проникающие затем вглубь листа и разрушающие его. Этот инфекционный процесс, который связан с только что описанной потерей «сопротивляемости структуры», является одной из причин гибели лесов.
Окислительные процессы, активизированные в клетке, воздействуют на систему этиленовых связей между стенками и мембраной клетки, при этом может выделяться этилен, индуцирующий опадение листьев и игл.
ПАН становится физиологически активным только при освещении. Под действием света он распадается фотолитически на NO2 и пероксиацетил-радикал (СН3СО2О*), который, окисляя, разрушает пигменты фотосинтеза и другие вещества в клетке.
Нет единого мнения по поводу оценки совместного действия О3 и SO2. В небольших концентрациях оба газа действуют явно синергически, т.е. угнетение роста растений, вызванное О3, усиливается в присутствии SO2.При высоких концентрациях, напротив, в присутствии SO2 эффект от действия О3 ослабляется; можно предположить, что при этом озон превращает большую часть образовавшейся в клетке сернистой кислоты в серную кислоту, обладающую меньшим фитотоксическим действием.
П р о б л е м ы г и б е л и л е с о в. Повреждения лесов наблюдались и раньше, особенно там, где деревья находились с подветренной стороны предприятий по переработке руд, но впервые масштабы бедствия стали столь велики. Эти повреждения захватывают теперь городские насаждения. Важные приметы гибели деревьев в настоящее время заключаются в усыхании и опадении листьев и игл с поредением кроны. Рост ствола дерева в высоту тормозится, образуется так называемое аистово гнездо на вершине дерева. Кольца годового прироста становятся тоньше, чем они были до начала заболевания дерева. На стволе ели образуется натёк, который простирается до основания ствола. Повреждённые берёзы часто образуют утолщения неопределённой формы в центре ствола. Больные хвойные деревья часто покрываются особо плотными шишками. Сосуществующие с корнями деревьев грибницы часто отмирают, на их месте появляется гниль. Виновника гибели лесов видят также в разрушающих древесину грибах (опёнок осенний). В то же время о действии вирусов и бактерий в качестве возбудителей болезней в таком масштабе пока нет конкретных данных, а о разрушающих древесину грибах известно, что они поражают уже повреждённые стволы и, таким образом, являются не причиной, а следствием болезни. Говоря о небиологических причинах гибели растений, наряду с экстремальными климатическими и прочими условиями, прежде всего, указывают на антропогенные загрязнения. При повреждении деревьев предельная концентрация SO2 составляет около 0,05 мг/м3 (0,019 млн.-1), что является среднегодовым показателем только для промышленных районов. В течение короткого времени в горных районах Средней Европы можно зафиксировать даже много большие концентрации.
При комбинированном действии SO2 и NO2 предельные концентрации каждого составляют 0,03 млн.-1. Такие концентрации и даже более высокие часто наблюдаются на территории Российской Федерации. В течение короткого времени предельная концентрация превышалась в 10-20 раз. Даже в умеренно загрязнённых районах 3- и 24-часовые средние значения ежемесячно многократно превышали критическую предельную концентрацию. Таким образом, фазы повреждения и отдыха всё время чередуются, в результате чего растение вообще плохо развивается. Такое ослабление жизнестойкости делает дерево восприимчивым к действию грибов, бактерий, жуков и других вредителей. Пагубно действие вредных смесей сложного состава, как, например, SO2 + NO2 + О3 + углеводороды или смеси этих газов с галогенами.
Повреждение лесов наблюдается не только в районах с повышенным содержанием SO2 и NO2, но и в так называемых районах чистого воздуха, в которых часто отмечают повышенные концентрации озона. Токсическая предельная концентрация составляет для деревьев 0,05 мг/м3. Таким образом, и в районах чистого воздуха, в которых встречаются только очень малые концентрации SO2 и NO2, могут происходить повреждения деревьев из-за антропогенных выбросов. Можно провести параллель между повреждением лесов в районах чистого воздуха и концентрацией вредоносного озона в атмосфере.
При прямом контакте кислотные осадки причиняют повреждения как во влажной, так и в сухой форме. Особую роль играют перехваченные осадки, т.е. кислотные осадки, задерживаемые кронами деревьев; их количество зависит не только от породы дерева (например, сосны задерживают в 2,5 раза больше кислотных загрязнений, чем берёзы), но и от расположения леса по отношению к розе ветров. Исследования в Западной Сибири показали, что вклад антропогенных кислот в почву в два раза превышает природную кислотность, образующуюся при разложении гумуса. Кислотность почвы определяется не количеством внесённых веществ кислотного характера, а её буферной ёмкостью, т.е. способностью обменивать различные катионы на ионы Н+. При наличии достаточного количества карбонатов значение рН не бывает ниже 6,2. Силикаты, содержащие щелочные металлы, как, например: полевой шпат, слюда, цинковая обманка, не допускают уменьшения рН ниже
6,2 – 5,0; глины и лёсс обеспечивают величину рН не ниже 6,8 – 4,2. При превышении буферной ёмкости щелочесодержащих силикатов в реакцию вступают алюмосиликаты, их буферное действие в области рН 4,5 – 3,0. Этот буфер при высвобождении Al3+ токсичен для корней растений и фауны почвы. Ниже рН 3,8 проявляется буферное действие соединений железа в почве.
Дальнейшее подкисление почвы вызывает ряд отрицательных последствий. К ним относятся уничтожение азотфиксирующих бактерий и актиномицет, отравление организмов, разрыхляющих почву (дождевые черви), десорбция питательных веществ растений (смываются дождями), а также повреждение грибниц. Таким образом, возникают нарушения поступления и недостаток питательных веществ у растения, что, помимо прямого повреждения растения, приводит к снижению его жизнеспособности. Отрицательное действие подкисления проявляется в сочетании с поступлением тяжёлых металлов из воздуха. В кислой среде ионы тяжёлых металлов, попавшие в почву из воздуха, сохраняют подвижность, могут быть усвоены корнями растений и фауной почвы. Токсическое действие тяжёлых металлов, активизированное кислотами, может проявляться различными путями.
Сложность проблемы гибели лесов заключается не только в том, что приходится иметь дело со всем многообразием газообразных выбросов, кислот и тяжёлых металлов, но и в том, что повреждению деревьев могут способствовать и такие природные факторы, как сухое и жаркое лето, чрезмерно холодная зима, пена морской солёной воды.
5.2.7. Фторхлоруглеводороды, N2O и стратосферный озон
Выше тропосферы с толщиной слоя около 11 км находится стратосфера. Здесь почти нет облаков, поэтому УФ-излучение значительно интенсивнее, чем на поверхности Земли. Это способствует возникновению многих новых реакций. Особенно следует отметить фотохимическое разложение молекулярного кислорода под действием коротковолнового УФ-излучения с длинами волн меньше 242 нм. Образующиеся атомы кислорода (с помощью вещества М, которое выходит из реакции неизменным) дают с молекулярным кислородом озон. Максимальное количество озона (концентрация около 7 млн.-1) находится на расстоянии 20 – 25 км от поверхности Земли. Эта озоновая оболочка, которая на полюсах расположена на несколько километров ближе к Земле, чем на экваторе, поглощает в УФ-области (максимум при 254 нм) и значительно слабее в ИК-области (при 600 нм). Поглощение энергии озоновым слоем существенно сказывается на запасе энергии в расположенной ниже атмосфере и заметно препятствует вертикальной конвекции воздуха. Таким образом, озоновый слой представляет собой весьма активную инверсионную область. Значение озонового слоя в жизнедеятельности Земли ещё больше вследствие того, что для озонового слоя максимум поглощения УФ-излучения (254 нм) очень близок к таковому для ДНК (260 нм). Заметим, что ДНК – носитель генетической информации всего живого. Озон защищает ДНК от индуцированных УФ-излучением биохимических изменений, вызывающих мутации. В ходе эволюции Земли живые существа смогли выйти из морей (также поглощающих УФ-излучение) на сушу только тогда, когда над землёй возникла первая озоновая оболочка. Таким образом, стратосферный озоновый слой над Землёй следует рассматривать как необходимую предпосылку существования на суше всего живого.
В настоящее время озон стратосферы страдает из-за антропогенного вмешательства, и необходимо установить главные факторы, ответственные за это вмешательство.
П р о и с х о ж д е н и е ф т о р х л о р у г л е в о д о р о д о в и N2O. Предполагают, что из всех антропогенных газов основную роль в разрушении стратосферного озона играют фторхлоруглеводороды (фреоны) и N2O. Фреоны, прежде всего CFCl3, CF2Cl2 и CHClF2, в течение длительного времени использовали в качестве распылителей при изготовлении аэрозольных упаковок. Сейчас они используются широко в холодильниках и кондиционерах, а также как пенообразователи при получении искусственных пен, стиральных и чистящих порошков. При получении пен фреоны образуют эмульсию с пенообразующими жидкостями. При застывании пены газ частично остаётся в её порах, частично переходит в атмосферу. Ежегодно используют около 2 млн. тонн этих веществ.
N2O поступает главным образом из почв, богатых азотом и бедных кислородом. Для «жёстких» ФХУ, молекулы которых не содержат связей С - Н (например CFCl3 или CF2Cl2) в тропосфере отсутствуют условия для химических превращений, поэтому эти соединения могут постепенно диффундировать в стратосферу. Продолжительность пребывания фторхлоруглеводородов в атмосфере оценивается в 100 и более лет. Только «мягкие» ФХУ (например СНClF2) могут претерпевать в тропосфере какие-либо изменения.
Ф о т о х и м и ч е с к и е р е а к ц и и в с т р а т о с ф е р е и п о -
л я р н а я о з о н о в а я д ы р а. Разрушение озонового слоя фторхлоруглеводородами (ФХУ) в стратосфере связано с тем, что под действием УФ-излучения освобождается хлор, который служит источником радикалов Cl*. На CCl3F активно действуют лучи с длиной волн меньше 230 нм, а на CCl2F2 – лучи с длиной волны меньше 220 нм. При фотолизе, кроме хлора, образуется ряд других соединений, частично по реакции с кислородными радикалами. Последние могут разрушать фторхлоруглеводороды с образованием радикалов Cl* и ClO*. Это радикалы могут явиться причиной разрушения озонового слоя, при этом идут следующие реакции
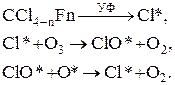 |
Радикалы Cl* вновь участвуют в разрушении озона, что позволяет говорить о каталитическом характере процесса. В результате этих реакций общее содержание озона в атмосфере в настоящее время уменьшилось на 1%. На высоте 40 км потери озона составляют уже около 8%. В течение 100 лет при неизменном поступлении ФХУ в атмосферу общая потеря озона может составить 5 – 7%. Значительно серьёзнее обстоят дела с потерями озона над Антарктидой. В октябре 1987 г. дефицит озона составлял почти 50%. В летний период содержание озона вновь восстановилось, но это до следующей антарктической зимы.
Процессы, приводящие к столь значительным, хотя и временным потерям, достаточно хорошо изучены. Важную роль играют стратосферные облака, образование которых связано с аэрозолями вулканического происхождения. При зимних температурах до - 80°С в облаках образуются кристаллики сильно охлаждённого льда, на поверхности которых протекает ряд гетерогенных реакций, которые связаны в первую очередь с образованием Cl* и ClO*, особенно ClO*; концентрация последнего в озонной дыре так велика, что его одного хватило бы для объяснения всех потерь озона. Сначала ClO* связывает NO2:
ClO* + NO2 ® ClONO2.
Образовавшийся «хлорнитрат» на холоде может быстро реагировать с соляной кислотой, при этом выделяется свободный Cl2 – источник радикалов; одновременно образовавшаяся азотная кислота растворяется во льду и таким образом выводится из газообразной реакционной смеси:
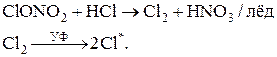 |
Образованные из НCl и НОCl (из ClОNO2) фотохимическим путём свободные радикалы Cl* и ClО* могут участвовать в разрушении озона. В то же время в Арктике зимние потери озона составляют около 5%. Таким образом, наряду с образованием колоссальной антарктической озонной дыры, в зимнее время регулярно образуется слабая арктическая озонная дыра. Эти сезонные озонные дыры оказывают известное влияние на общее содержание озона в стратосфере.
Вместе с СО2 галогеноуглероды участвуют в создании парникового эффекта в атмосфере, так как они поглощают ИК-излучение в области 700 – 1300 нм, т.е. в той области, в которой СО2 пропускает ИК-лучи. Разрушение озона в стратосфере приводит к разогреванию тропосферы, так как всё больше богатых энергий УФ-лучей проникает в тропосферу и поглощается в ней. Поэтому влияние ФХУ на нагревание тропосферы таит в себе ещё большую опасность, чем усиление УФ-излучения вблизи поверхности Земли. Однако надо серьёзно считаться с действием усиленного УФ-излучения и в нижних слоях тропосферы. У людей, особенно со светлой кожей, значительно возрастает опасность раковых заболеваний под действием повышенных доз
УФ-облучения. Кроме того, снижаются рост и участие в фотосинтезе ряда растений, в том числе и культурных, что приводит к потере озона стратосферы.
Вышеизложенное заставляет сделать вывод о необходимости резкого сокращения производства фторхлоруглеводородов (фреонов) и обеспечения холодильников и кондиционеров надёжными циркуляционными системами, не допускающими утечки хладагента. Однако это находится в противоречии с техническими и экономическими интересами производителей фреонов, так как изготовление последних связано с производством NaOH, HCl, Cl2, а также с рядом других синтезов. Сокращение производства фреонов влечёт за собой сокращение производств хлора, соляной кислоты и едкого натра, что снизит доходы производящих эти продукты фирм.
Ведущаяся уже с 1974 г. дискуссия о возможности разрушения озонового слоя в стратосфере побудила рассмотреть возможности сокращения производства фторхлоруглеводородов и привлекла внимание к обсуждению надёжности такого прогнозирования. В настоящее время вредное воздействие фреонов на атмосферу можно считать однозначно установленным. Однако всем требованиям об изъятии этих веществ из обращения противостоят трудности перестройки в короткие сроки химических производств.
Помимо фторхлоруглеводородов причиной разрушения озонового слоя является также оксид диазота N2О. Этот газ сохраняется в атмосфере в течение десяти лет. В стратосфере N2О реагирует с образующимися фотолитически радикалами О* и ОН* по реакции
N2О + О* ® 2 NО.
NО может реагировать с озоном, образуя NО2 и О2. Разрушительное для озона действие N2О сильно проявляется в нижних слоях стратосферы на высоте 20 – 30 км. Действие других оксидов азота проявляется подобно действию N2О; они попадают в стратосферу с продуктами сгорания топлива ракетных и авиационных двигателей. Главным источником поступления оксидов азота в атмосферу служит сельское хозяйство. Сокращение этого поступления возможно при умеренном потреблении азотсодержащих удобрений, а также при сокращении посевов риса, где на затопленных неделями участках протекают анаэробные процессы. Однако эти мероприятия не реализуются, так как из-за постоянного роста населения Земли всё больше обостряется продовольственная проблема; кроме того, современные высокопродуктивные сельскохозяйственные культуры требуют применения азотсодержащих удобрений. Наиболее надёжным выходом из создавшегося положения было бы регулирование роста численности населения на нашей планете. До того как будет установлен предел росту народонаселения, придётся считаться с ежегодным увеличением содержания N2О в атмосфере на 0,2 – 0,3%, как это было во все предшествующие годы.
В последнее время возникло предположение, что в разрушении озонового слоя участвует также метан. В течение ряда лет концентрация метана в атмосфере непрерывно возрастает. Достоверных теорий о химизме разрушения озона метаном пока не предложено.
Date: 2015-09-27; view: 1334; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |