
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Этапы микроклонального размножения растений
Процесс клонального микроразмножения можно разделить на 4 этапа:
1. Выбор растения-донора, изолирование эксплантов и получение хорошо растущей стерильной культуры.
2. Собственно микроразмножение, когда достигается получение максимального количества меристематических клонов.
3. Укоренение размноженных побегов с последующей адаптацией их к почвенным условиям, а при необходимости депонирование растений-регенерантов при пониженной температуре (+2оС, +10оС).
4. Выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле.
Для культивирования тканей на каждом из четырех этапов требуется применение определенного состава питательной среды.
На первом этапе необходимо добиться получения хорошо растущей стерильной культуры. В тех случаях, когда трудно получить исходную стерильную культуру экспланта, рекомендуется вводить в состав питательной среды антибиотики (тетрациклин, бензилпенициллин и др.) в концентрации 100—200 мг/л. Это в первую очередь относится к древесным растениям, у которых наблюдается тенденция к накоплению внутренней инфекции.
На первом этапе, как правило, используют среду, содержащую минеральные соли по рецепту Мурасига и Скуга, а также различные биологически активные вещества и стимуляторы роста (ауксины, цитокинины) в различных сочетаниях в зависимости от объекта. В тех случаях, когда наблюдается ингибирование роста первичного экспланта, за счет выделения им в питательную среду токсичных веществ (фенолов, терпенов и других вторичных соединений), снять его можно, используя антиоксиданты. Это возможно двумя способами: либо омывкой экспланта слабым его раствором в течение 4—24 ч, либо непосредственным добавлением в питательную среду. В качестве антиоксидантов используют: аскорбиновую кислоту (1 мг/л), глютатион (4—5 мг/л), дитиотриэтол (1—3 мг/л), диэтилдитиокарбомат (2—5 мг/л), поливинилпирролидон (5000—10000 мг/л). В некоторых случаях целесообразно добавлять в питательную среду адсорбент - древесный активированный уголь в концентрации 0,5—1%. Продолжительность первого этапа может колебаться от 1 до 2 месяцев, в результате которого наблюдается рост меристематических тканей и формирование первичных побегов.
2 этап — собственно микроразмножение. На этом этапе необходимо добиться получения максимального количества мериклонов, учитывая при этом, что с увеличением субкультивирований увеличивается число растений-регенерантов с ненормальной морфологией и возможно наблюдать образование растений-мутантов.
Как и на первом этапе, используют питательную среду по рецепту Мурасига и Скуга, содержащую различные биологически активные вещества, а также регуляторы роста. Основную роль при подборе оптимальных условий культивирования эксплантов играют соотношение и концентрация внесенных в питательную среду цитокининов и ауксинов. Из цитокининов наиболее часто используют БАП в концентрациях от 1 до 10 мг/л, а из ауксинов—ИУК и НУК в концентрациях до 0,5 мг/л.
При долгом культивировании растительных тканей на питательных средах с повышенным содержанием цитокининов (5—10 мг/л) происходит постепенное накопление их в тканях выше необходимого физиологического уровня, что приводит к появлению токсического действия и формированию растений с измененной морфологией. Вместе с тем, возможно наблюдать такие нежелательные для клонального микроразмножения эффекты, как подавление пролиферации пазушных меристем, образование витрифицированных (оводненных) побегов и уменьшение способности растений к укоренению. Отрицательное действие цитокининов возможно преодолеть, по данным Н.В. Катаевой и Р.Г. Бутенко, путем использования питательных сред с минимальной концентрацией цитокининов, обеспечивающих стабильный коэффициент микроразмножения, или путем чередования циклов культивирования на средах с низким и высоким уровнем фитогормонов.
3 и 4 этапы — укоренение микропобегов, их последующая адаптация к почвенным условиям и высадка в поле являются наиболее трудоемкими этапами, от которых зависит успех клонального микроразмножения. На третьем этапе, как правило, меняют основной состав среды: уменьшают в два, а иногда и в четыре раза концентрацию минеральных солей по рецепту Мурасига и Скуга или заменяют ее средой Уайта, уменьшают количество сахара до 0,5—1% и полностью исключают цитокинины, оставляя один лишь ауксин. В качестве стимулятора корнеобразования используют β-индолил-3-масляную кислоту (ИМК), ИУК или НУК.
Укоренение микропобегов проводят двумя способами:
1) выдерживание микропобегов в течение нескольких часов (2—24 ч) в стерильном концентрированном растворе ауксина (20—50 мг/л) и последующее их культивирование на агаризованной среде без гормонов или непосредственно в подходящем почвенном субстрате (импульсная обработка);
2) непосредственное культивирование микропобегов в течение 3—4 недель на питательной среде, содержащей ауксин в невысоких концентрациях (1—5 мг/л в зависимости от исследуемого объекта). В последнее время предложен метод укоренения пробирочных растений в условиях гидропоники. Этот метод позволяет значительно упростить этап укоренения и одновременно получать растения, адаптированные к естественным условиям. Для картофеля возможно использовать безсубстратную гидропонику для получения мини-клубней. Затенение нижней части культуральных сосудов плотной черной материей или добавление в питательную среду активированного угля способствует укоренению микропобегов.
Пересадка растений-регенерантов в субстрат является ответственным этапом, завершающим процесс клонального микроразмножения. Наиболее благоприятное время для пересадки пробирочных растений — весна или начало лета.
Растения с двумя-тремя листьями и хорошо развитой корневой системой осторожно вынимают из колб или пробирок пинцетом с длинными концами или специальным крючком. Корни отмывают от остатков агара и высаживают в почвенный субстрат, предварительно простерилизованный при 85—90° С в течение 1—2 ч. Для большинства растений в качестве субстратов используют торф, песок (3:1); торф, дерновую почву, перлит (1:1:1); торф, песок, перлит (1:1:1). Исключение составляют семейство орхидных, для которых готовят субстрат, состоящий из сфагнового мха, смеси торфа, листьев бука или дуба, сосновой коры (1:1:1).
Приготовленным заранее почвенным субстратом заполняют пикировочные ящики или торфяные горшочки, в которых выращивают растения-регенеранты. Горшочки с растениями помещают в теплицы с регулируемым температурным режимом (20—22° С), освещенностью не более 5 тыс. лк и влажностью 65—90%. Для лучшего роста растений создают условия искусственного тумана. В тех случаях, когда нет возможности создать такие условия, горшочки с растениями накрывают стеклянными банками или полиэтиленовыми пакетами, которые постепенно открывают до полной адаптации растений.
Через 20—30 дней после посадки хорошо укоренившиеся растения подкармливают растворами минеральных солей Кнудсона, Мурасига и Скуга, Чеснокова, Кнопа (в зависимости от вида растений) или комплексным минеральным удобрением. По мере роста растений их рассаживают в большие емкости со свежим субстратом. Дальнейшее выращивание акклиматизированных растений соответствует принятой агротехнике выращивания для каждого индивидуального вида растений.
Процесс адаптации пробирочных растений к почвенным условиям является наиболее дорогостоящей и трудоемкой операцией. Нередко после пересадки растений в почву наблюдается остановка в росте, опадение листьев и гибель растений. Эти явления связаны, в первую очередь, с тем, что у пробирочных растений нарушена деятельность устьичного аппарата, вследствие чего происходит потеря большого количества воды. Во-вторых, у некоторых растений в условиях in vitro не происходит образования корневых волосков, что приводит, в свою очередь, к нарушению поглощения воды и минеральных солей из почвы. Поэтому целесообразно на третьем или четвертом этапах клонального микроразмножения применять искусственную микоризацию растений (для микотрофных), учитывая их положительную роль в снабжении растений минеральными и органическими питательными веществами, водой, биологически активными веществами, а также в защите растений от патогенов.
Индийскими учеными предложен простой метод предотвращения быстрого обезвоживания листьев растений, выращенных in vitro, во время их пересадки в полевые условия. Метод заключается в том, что листья в течение всего акклиматизационного периода следует опрыскивать 50%-ным водным раствором глицерина или смесью парафина, или жира в диэтиловом эфире (1:1). Применение этого метода помогает избежать длинных и затруднительных процессов закаливания пробирочных растений и обеспечивает 100%-ную их приживаемость.
Вопрос № 7. Методы, повышающие частоту слияния протопластов.
Изолированные протопласты, еще не образовавшие клеточной стенки, могут сливаться между собой. Слияние протопластов ― своеобразный метод гибридизации, так называемая парасексуальная, или соматическая гибридизация. В отличие от обычной, где сливаются половые клетки (гаметы), в качестве родительских при парасексуальной гибридизации используются диплоидные клетки микроорганизмов. Техника парасексуальной гибридизации может позволить:
· скрещивание генетически отдаленных видов микроорганизмов;
· получение асимметричных гибридов, несущих генный набор одной из материнских клеток наряду с несколькими хромосомами, органеллами или цитоплазмой другой;
· слияние трех и более клеток;
· получение гибридов, представляющих сумму генотипов материнских клеток;
· перевод мутаций в гетерозиготное состояние, что позволяет получать жизнеспособные формы при слиянии протопластов;
Парасексуальная гибридизация важна для анализа как ядерных генов, так и внеядерных геномов. Цитоплазматический геном кодирует ряд признаков - скорость деления, устойчивость к патогенам, абиотическим факторам и т. д.
Слияние бывает спонтанным (чаще у протопластов молодых клеток или суспензионных культур) и индуцированным. Для стимуляции слияния протопластов предложен ряд методов, как физических, так и химических.
Для слияния протопластов используют два основных подхода:
1. Использование полиэтиленгликоля (ПЭГ) в сочетании с высоким рН (9-11) среды и повышенным содержанием ионов кальция Са2+(100-300мМ). Полиэтиленгликоль выполняет роль индуктора слияния, который обеспечивает агглютинацию (слипание). Высокое значение рН и высокая концентрация ионов кальция необходимы для нейтрализации отрицательного поверхностного заряда, который имеют протопласты. В местах слипания происходит разрыв плазмалемм протопластов, приводящий к их слиянию. На этот процесс оказывают влияние, помимо внешних факторов, особенности тканевой принадлежности клеток. Легко сливаются меристемные и каллусные протопласты, менее эффективно сливаются сильно вакуолизированные клетки и клетки с развитыми хлоропластами (например, мезофильные протопласты).
2. Электрослияние протопластов. В этом случае протопласты помещают в неоднородное переменное электрическое поле. В этих условиях протопласты образуют мостик из нескольких клеток между электродами. После пропускания единичных импульсов тока происходит слияние протопластов в результате разрыва их плазмалемм. Эффективность метода слияния протопластов определяют по частоте слившихся протопластов, частоте клеточных клонов, образовавшихся из гибридных клеток, а также частоте образования гибридных проростков. В результате слияния протопластов образуются гомокарионы ― продукты слияния генетически идентичных клеток, и гетерокарионы ― продукты слияния генетически неидентичных клеток.
Далее возможны следующие варианты поведения слившихся протопластов:
· синхронное деление двух ядер без их слияния и образование в результате исходных делений двуядерных дочерних клеток;
· слияние ядер во время митотического деления и формирование в дальнейшем одноядерных гибридных дочерних клеток.
Введение микроорганизмов в изолированные протопласты растений проводят при воздействии на иих специальными индуцирующими факторами. Микроорганизмы могут поглощаться протопластами или сливаться с ними. Протопласты гороха поглощали клетки Rhizobium непосредственно в процессе ферментативногоразрушения клеточных стенок клеток мезофилла листа при получении изолированных протопластов. Во всех остальных случаях в качестве индуктора поглощения или слияния применяли полиэтилеигликоль (ПЭГ), который известен как агент, повышающий частоту слияния протопластов высших растений.
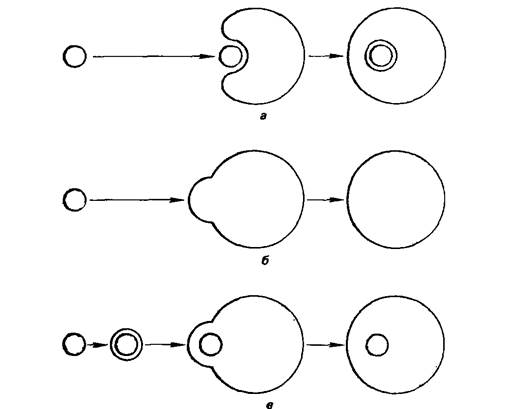
Рис. 1.6. Введение Микроорганизмов в протопласты высших растений
А)поглощение путем инвагинации мемраны(эндоцитоз)
Б)Слияние мембран
В)слияние мембран протопласта с липосомой
Date: 2015-09-25; view: 817; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |