
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Моль – кількість речовини, що містить стільки молекул, атомів, іонів,електронів чи інших структурних одиниць, скільки міститься атомів в 12 г ізотопу Карбону
Сучасний розвиток техніки дозволяє точно визначити число структурних одиниць, що містяться в 1 молі речовини. Це число носить назву числа Авогадро і дорівнює
NA=6,023·1023 моль-1
Кількість молів позначається літерою 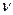 .
.



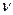 N - кількість структурних одиниць
N - кількість структурних одиниць
NA
Маса одного моля речовини називається мольною масою: М.
Мольна маса речовини, що виражена в г/моль, чисельно дорівнює відносній молекулярній масі Мr, якщо речовина складається з молекул, або відносній атомній масі, якщо речовина складається з атомів.

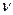 = m
= m
M
Якщо знаємо мольну масу речовини, можна розрахувати число молей 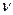 та молекул N для даної маси m:
та молекул N для даної маси m:


 N m
N m
 NA M
NA M
Закон Авогадро має два наслідки:
Наслідок І: однакова кількість молекул різних газів при однакових умовах займає однаковий об’єм, тобто об’єм 1 моль будь-якого газу - величина постійна. Об’єм 1 моля газу – мольний об’єм.
При н. у. (101,3 кПа, 0оС) – 22,4 л/моль.

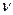 = V
= V
Vm




 V m або V N
V m або V N


 Vm M Vm NA
Vm M Vm NA
Наслідок ІІ: відносна густина одного газу по другому дорівнює відношенню їх молярних мас (для однакових V та P, T)
D = М1 / M2
D 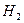 = М/2
= М/2 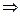 М = 2· D
М = 2· D 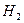
D возд = М/29 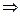 М = 29· D возд
М = 29· D возд
Якщо при н.у. Vл газу важить m г, то:
V - m
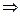 M = m/V · 22,4 =
M = m/V · 22,4 = 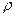 · 22,4
· 22,4
22,4 - M
Тому можна розрахувати мольну масу по відносній густині та через мольний об’єм.
Крім цього мольну масу можна знайти з рівняння Менделєєва-Клапейрона, якщо ми маємо справу з газами, як в попередньому випадку:
PV = mRT/M,
де R – універсальна газова стала, значення якої не залежить від природи газу.
R = 8,31 Дж/К·моль.
Якщо умови реакції відрізняються від нормальних, то можна для розрахунків використовувати рівняння об'єднаного газового закону:
РV/T = P0V0/T0;
де Р0 = 101,3 кПа, Т0 = 273 К,
V0 – об’єм газу при н.у.,
P,V,T –тиск, об’єм та температура, що існують.
Ми згадали сьогодні майже всі основні поняття та деякі закони хімії. Залишилося згадати одне поняття, а саме
хімічним рівнянням називають умовний запис хімічної реакції за допомогою хімічних формул та математичних знаків:
2Н2 + О2 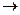 2Н2О
2Н2О
Вірність написання рівняння визначається законом збереження маси речовин Ломоносова-Лавуазьє, який лежить в основі всіх процесів Всесвіту:
Date: 2015-09-05; view: 513; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |