
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глава 4. НЕПРОХОДИМОСТЬ ЖЕЛЧНЫХ ПРОТОКОВ ДОБРОКАЧЕСТВЕННОЙ ЭТИОЛОГИИ 11 page
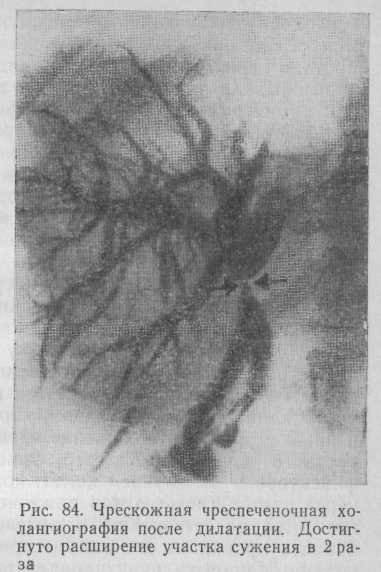
Таким образом, хирургическое лечение больных с рубцовыми стриктурами желчных протоков объединяет в себе закрытый способ — чрескожную чреспеченочную дилатацию и открытый, включающий восстановительные и реконструктивные операции.
Чрескожная чреспеченочная дилатация. Впервые операцию выполнили при рубцовых стриктурах желчных протоков Molnar и Stockum в 1978 г.
Мы выполнили эту операцию у 4 (1,5 %) женщин в возрасте от 29 до 75 лет. У всех больных причиной стриктуры желчных протоков были технические ошибки, допущенные во время холецистэктомии. Трем больным дважды выполняли реконструктивные операции с формированием гепатикоеюноанасто-моза. Все больные поступили в клинику института с механической желтухой и хроническим рецидивирующим холангитом. Продолжительность основного заболевания составляла в среднем 3,5 года. После общеклинических и лабораторных исследований всем больным выполнена чрескожная чреспеченочная холангиостомия с последующей дилатацией.
Операцию производили в рентгеноперационной под контролем рентгенотелевизионной установки. За 20 мин до исследования назначали промедол — 2 мл 2 % раствора, атропина сульфат — 0,5 мл 0,1 % раствора, димедрол — 1 мл 1 % раствора, реланиум или седуксен — 2 мл. Под местной анастезией 0,25 % раствором новокаина с добавлением 0,1 % раствора адреналина гидрохлорида через восьмое межреберье по средней подмышечной линии справа иглой Chiba выполняли чрескожную чреспеченочную хо-лангиографию. Для уменьшения повреждающего действия контрастного вещества на стенки протоков для контрастирования применяли разбавленный в 2 раза 76 % раствор верографина. После определения уровня непроходимости и ширины внутрипеченочных
протоков производили чрескожную чреспеченочную холангиостомию. Если при выполнении холангиографии были пунктированы протоки первого или второго порядка и игла по отношению к ним образовывала тупой угол, в нее вводили металлический проводник диаметром 0,45 мм, а иглу извлекали. На проводник насаживали иглу с пункционным катетером диаметром 1,5 мм и вращательными движениями продвигали через ткань печени до введения катетера в проток. После извлечения иглы и проводника под давлением поступала желчь, которую брали для бактериологического исследования. В катетер вводили проводник диаметром 0,8 мм с мягким изогнутым концом, который продвигали к месту обтурации вместе с пункционным катетером. Заменив узкий проводник более широким (с диаметром 0,95 мм), проходили через суженную часть стриктуры. Пункционный катетер извлекали, канал в печени и отверстие в стенке протока расширяли тефлоно-вым дилататором. По проводнику вводили дренирующий катетер диаметром 2,1 мм с множественными боковыми отверстиями в дистальном отделе и с загнутым в виде кольца концом. Катетер устанавливали таким образом, чтобы отверстия находились выше и ниже стриктуры, положение их контролировали введением контрастного вещества. Катетер фиксировали к коже специальным фиксатором. В случае, когда холангиография была выполнена через проток третьего или даже четвертого порядка либо положение иглы по отношению к долевым протокам не позволяло направить проводник к области стриктуры, иглой Chiba контрасти-рованные протоки пунктировали повторно в необходимом направлении. На 2-е — 3-й сутки под местной анастезией заменяли катетер диаметром 2,1 мм на дренирующий катетер диаметром 3,5 мм. В целях ликвидации симптомов холангита и снижения билирубинемии всем больным в течение 7 сут проводили наружное дренирование желчных протоков. Параллельно назначали противовоспалительную терапию, включающую антибиотики с учетом чувствительности к ним высеянной микрофлоры (карбенициллина динатриевая соль, цефатриксил, диоксидин, полимиксина М сульфат, гентамицина сульфат, фурагин). Впоследствии отверстие дренажа закрывали. Пассаж желчи осуществлялся только в кишечник. После улучшения состояния больных и основных функциональных показателей печени, снижения лейкоцитоза производили чрескожную чреспеченочную дилатацию стриктуры — 3 сеанса с интервалом 5 сут. Дилатацию также выполняли в рентгенопе-рационной после премедикации. Для дилатации применяли катетер Gruntrig с длиной баллона 30 мм и диаметром 10 мм. Катетер вводили по проводнику и устанавливали его таким образом, чтобы область стриктуры располагалась в средней части баллона. Через манометр катетер соединяли со шприцем емкостью 10 мл и вводили разбавленное контрастное вещество в баллон, создавая в нем давление 6 атм, которое удерживалось в течение 1—3 мин. При первом раздувании баллона стриктура деформировала его стенку, при двух последующих отмечалось полное расправление баллона. Во время первого сеанса дилатации почти все больные жаловались на сильную тупую боль, которую снимали внутривенным наркозом. Последующие 2 сеанса дилатации были менее болезненны, больным вводили внутривенно аналгетики и седатив-ные средства. После сеанса дилатации катетер Gruntrig заменяли дренирующим катетером диаметром 3 мм и вводили рентгеноконт-растное вещество для контроля эффективности расширения стриктуры. В течение всего периода дренирования состояние больных было удовлетворительным.
Из 3 больных с Рубцовым сужением гепатикоеюноанастомоза у 2 описанная методика была эффективна. Диаметр анастомоза увеличился в среднем до 6 мм. У этих больных были оставлены тонкие дренажи без отверстий для последующего контроля ширины анастомоза и профилактики возможного повторного сужения. Холангиография, выполненная через 7 мес, свидетельствовала о сохранении размеров анастомоза. У третьей больной ширина анастомоза после дилатации составляла 5 мм, однако во время сеансов дилатации баллон ни разу не удалось полностью расправить. Больная отказалась от дренажа и дальнейшего лечения. Через 4 мес у нее возобновились симптомы холангита, а спустя 6 мес появилась перемежающаяся желтуха. Ретроспективно оценивая это наблюдение, следует отметить, что в подобных случаях показано электрорассечение стриктуры с последующей дилатацией.
У 1 больной с рубцовой стриктурой печеночно-желудочного протока, возникшей после пластики общего желчного протока, дилатация оказалась наиболее эффективной. Уже во время второго сеанса баллон расправился полностью. Оставлен дренаж диаметром 3 мм, который был удален через 2,5 мес. При контрольном исследовании ширина печеночно-желчного протока в области стриктуры составляла 6 мм. Спустя 1,5 года состояние больной удовлетворительное, жалоб не предъявляет.
Анализируя полученные результаты, мы пришли к выводу, что чрескожная чреспеченочная дилатация является безопасным и надежным методом лечения различных видов Рубцовых стриктур желчных протоков и с него необходимо начинать хирургическую коррекцию этой патологии. Применение чрескожной чреспеченоч-ной дилатации при первичных стриктурах желчных протоков наиболее эффективно. При ригидных стриктурах гепатикоеюноанастомоза целесообразно комбинировать дилатацию с электрорассечением. При сомнительных результатах чрескожной чреспеченоч-ной дилатации показан транспеченочный дренаж. В тех случаях, когда удается выполнить лишь канюлирование внутрипеченочных
желчных протоков (полное заращение), операцию заканчивают наружным дренированием и она является подготовительным этапом для оперативного лечения после уменьшения билирубинемии и явлений холангита.
Несмотря на перспективность описанного метода лечения, выполнить его можно лишь в условиях специализированного отделения при наличии рентгенотелевизионных аппаратов, соответствующего инструментария и определенном навыке. В обычных условиях можно рассчитывать только на выполнение чрескожной чрес-печеночной холангиографии.
Восстановительные операции. К ним относятся: 1) пластическая операция типа Гейнеке—Микулича, 2) билио-билиарные анастомозы, 3) пластическое закрытие дефектов печеночно-желчного протока с использованием аутоткани, 4) бужирование. Нами выполнено 79 (23,5 %) подобных операций у 65 больных (табл. 14).
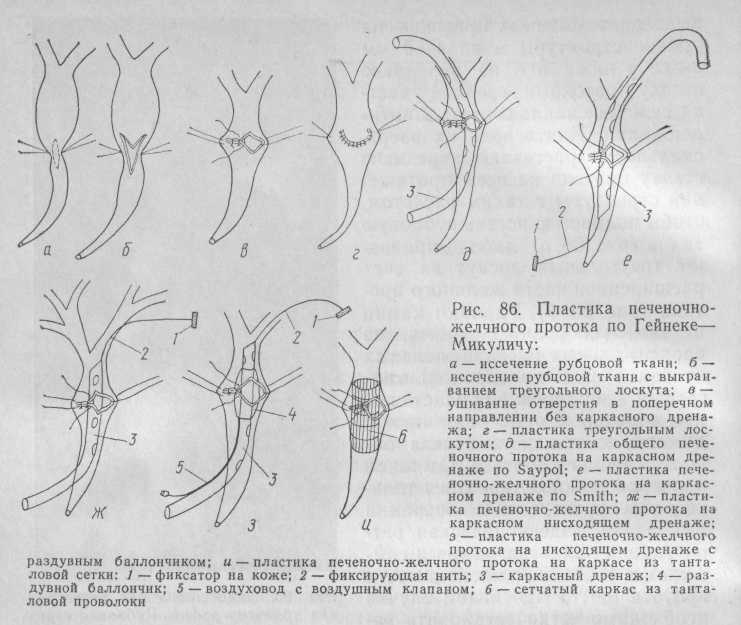
Пластика печеночно-желчного протока по Гейнеке — Микуличу — наиболее распространенная операция при выполнении восстановительных вмешательств. По нашим данным, она составляет 58,2 %. Операция может быть выполнена на любом уровне печеночно-желчного протока, если циркулярное поражение рубцовым процессом охватывает не более 2/з его диаметра, а протяженность стриктуры составляет не более 10 мм (рис. 85).

Обычно такие стриктуры возникают вследствие захвата части стенки желчного протока в лигатуру при перевязке культи пузырного протока во время холецистэктомии или при грубых манипуляциях во время прошивания или перевязки пузырной артерии. Образующиеся пристеночные рубцовые стриктуры располагаются главным образом на уровне культи пузырного протока (95%), реже в области общего печеночного протока и выше, вплоть до места слияния долевых печеночных протоков и даже в области одного из них, чаще правого (5 %).
Техника операции заключается в следующем. После выделения желчных протоков на уровне стриктуры и на 4—5 мм выше и ниже нее на переднюю стенку протока посередине участка сужения накладывают 2 нити-держалки. Подтягивая их вверх, скальпелем рассекают переднюю стенку протока на всем протяжении стриктуры с таким расчетом, чтобы полностью иссечь рубцовую ткань (рис. 86, а), либо выкраивают треугольный лоскут за счет расширенной части желчного протока (рис. 86, б). Удаляют камни и замазкообразную желчь из проксимальных отделов желчных протоков. С помощью холангиографии и зондирования эластическим катетером проверяют проходимость дистального отдела общего желчного протока. От такой проверки можно отказаться только в том случае, если до операции выполнена эндоскопическая ретроградная холангиография и сомнений в свободной проходимости протока нет. В противном случае необходимо четко установить характер патологии и устранить ее сразу во время операции путем трансдуоденальной папиллосфинктеротомии или после операции путем эндоскопической папиллосфинктеротомии. Растягивая держалки в противоположные стороны, превращают продольный разрез протока в поперечный. Затем решается вопрос о необходимости каркасного дренирования. Как показал опыт, лишь в редких случаях можно обойтись без него, хотя операция без дренажа является идеальным вариантом. Мы не применили каркасное дренирование у 19,6 % больных (рис. 86, в, г), у которых циркулярное поражение занимало менее 1/3 диаметра протока, а сам диаметр протока был не менее 10 мм. Нами использованы различные виды каркасного дренирования при восстановительных операциях (рис. 86, д, е, ж, з, и). Наименее травматичным для печени и желчных протоков оказался нисходящий дренаж. Введение такого дренажа не представляет сложностей. Металлический зонд вводят в просвет дистального отдела общего желчного протока со стороны вскрытой его части и выпячивают им латеральную стенку протока над местом вхождения его в ткань поджелудочной железы. В этом месте проток рассекают скальпелем на протяжении 2—3 мм и дренаж ретроградно втягивают в проток. После установления дренажа в нужном положении отверстие в ретродуоденальной части общего желчного протока герметизируют вокруг дренажа кисетным швом за счет окружающих тканей и частично стенки протока прочной нерассасы-вающейся нитью. Ею же фиксируют и сам дренаж для предотвращения его смещения во время операции. Нисходящее дренирование мы применили у 26 (56,5 %) больных. Следует отметить, что этот вид дренирования является и самым неуправляемым. Дренаж часто смещается, преждевременно выскальзывает из желчного протока, а придать ему прежнее положение практически невозможно, что в большинстве случаев приводит к рецидиву заболевания. Чтобы превратить этот дренаж в управляемый, мы стали фиксировать его проксимальный конец нитью (см. рис. 86, ж), проведенной через прокол левого печеночного протока на переднюю брошную стенку и фиксированную к коже специальным фиксатором. Для большей атравматичности нить перед ее выведением из протока проводят через тонкую хлорвиниловую трубочку. Образующееся гладкое покрытие предотвращает прорезывание нити через ткани в процессе длительного лечения. Такой дренаж можно оставлять в нужном положении длительное время и при необходимости заменять другим. Диаметр каркасного дренажа подбирают во время операции. Он должен соответствовать диаметру дистального отдела общего желчного протока (обычно 5— 7 мм). Больший диаметр трубки не позволяет провести ее через дистальный, всегда суженный отдел общего желчного протока, резко деформирует проток и требует создания большего отверстия в ретродуоденальной части протока для проведения трубки.
Учитывая то обстоятельство, что установить на уровне пластики протока трубку диаметром, который полностью соответствовал бы диаметру протока, практически невозможно при использовании обычных трубчатых дренажей (каркасный дренаж, к сожалению, всегда имеет диаметр меньше желаемого), мы применили дренаж с раздувным баллоном. Баллон устанавливают на уровне пластики протока, диаметр же самого дренажа уже не имеет существенного значения и может быть меньше обычного — 3— 4 мм (см. рис. 86, з). Устанавливают баллон при помощи фиксирующей нити на таком уровне, чтобы середина его находилась напротив шовного соединения стенок протока. После ушивания отверстия в протоке баллон заполняют контрастным веществом без особого давления, но так, чтобы стенки его плотно прилегали к стенкам протока. Отток желчи осуществляется через отверстия в дренажной трубке выше и ниже баллона. Таким образом, сразу после пластики протока на ее уровне устанавливают каркас нужного диаметра и формирующийся анастомоз достигает максимальной ширины. Кроме того, при использовании баллона появляется возможность постоянной дилатации анастомоза в процессе его формирования. Дилатацию осуществляет сам больной через 8— 10 сут после операции путем периодического отсасывания из баллона и нагнетания в него жидкости до появления болезненного ощущения. Дилатацию производят 2 раза в день в течение 3 мес. Затем дренаж после рентгенологического контроля удаляют. Дренаж такого типа при пластике печеночно-желчного протока по Гейнеке—Микуличу мы использовали у 3 (6,6 %) больных. Это позволило значительно сократить сроки дренирования (с 12—18 мес при обычных дренажах до 3—6 мес с применением дилатации).
Несмотря на положительные свойства нисходящего каркасного дренирования, применение его ограничено теми случаями, когда пластика протока выполняется в нижней, средней и частично в верхней частях печеночно-желчного протока, где проксимальный конец дренажа можно зафиксировать выше уровня пластики протока. К сожалению, чем выше линия швов, тем труднее установить нисходящий дренаж и тем меньше эффективность его каркасной функции. В этих случаях приходится прибегать к транспеченочному проведению каркасных дренажей. Часто хирурги, и мы в том числе, применяют дренирование по Smith (17,4 % — см. рис. 86, е). Этот вид дренирования предусматривает более устойчивое положение каркасного дренажа, хотя он и является полууправляемым. Остается опасность его смещения и выскальзывания, а смена его всегда сопряжена с риском невозможности поставить новый дренаж на прежнее место. Для устранения этих недостатков мы фиксируем его дистальный конец ниткой-держалкой, которую выводим на кожу боковой поверхности брюшной стенки через прокол в ретродуоденальной части общего желчного протока. При наличии стриктур, располагающихся в месте слияния долевых печеночных протоков или в области одного из них, в случае выполнения пластики по Гейнеке—Микуличу для большей надежности приходится применять дренирование по Saypol (6,5 % — см. рис. 86, д), когда один конец дренажа выводят транспеченочно, а другой — через разрез ретродуоденальной части общего желчного протока. Такое дренирование рассчитано на длительное время (2 года и более). Дренаж полностью управляем и легко подлежит замене, которую производят каждые 6 мес в связи с инкрустацией его желчными солями и одеревенением. Трубку для транспеченочного дренирования подбирают во время операции. Обычно она имеет диаметр 5 мм. Во всех каркасных дренажах делают боковые отверстия, обеспечивающие хорошую циркуляцию оттекаемой по печени желчи.
Стремление создать более надежный и стойкий каркас при выполнении восстановительных операций, сократить сроки лечения до минимальных (10—15 дней), исключить инвалидизацию больных (больные с каркасными дренажами обычно являются инвалидами II группы) заставило нас искать новые пути решения этой задачи. Нами изобретен сетчатый трубкообразный каркас из танталовой проволоки толщиной 0,1 мм (см. рис. 86, и). Каркас подбирают на операции по диаметру протоков и устанавливают на уровне пластики. Временно (на 6—8 сут) в желчный проток вводят тонкую трубочку для рентгеновского контроля. Такой каркас при восстановительной операции применен нами у 1 больной с хорошим результатом в течение 8 лет.
После решения вопроса о способе дренирования или введения каркаса края протока по периметру иссеченной ткани сшивают в поперечном направлении узловыми швами из тончайшего (3/0, 5/0) рассасывающегося материала (хромированного кетгута, дек-сона и др.) на атравматической игле. При отсутствии нитей из рассасывающихся материалов можно использовать синтетическую нить типа синтофила и др. Обязательным является тщательное сопоставление краев протока. Если позволяет толщина стенок протока, не следует прокалывать слизистую оболочку. Применяют П-образный шов с выворачиванием краев по типу сосудистого шва при сшивании «конец в конец», но для этого нужен дополнительный участок стенки протока. Операцию заканчивают подведением к месту пластики протока в подпеченочное пространство перчаточно-трубчатого дренажа.
Пластику желчного протока по Гейнеке—Микуличу производят также при свежей травме, когда повреждение не превышает 2/3 диаметра его. На противоположные края дефекта накладывают держалки и, растягивая их, превращают участок повреждения в линию, расположенную поперек оси протока. Устанавливают дренаж и сшивают края протока, как это описано выше. Подпеченочное пространство дренируют перчаточно-трубчатым дренажем.
Билио-билиарные анастомозы по типу «конец в конец» представляют собой второй вид наиболее распространенных восстановительных операций при рубцовых стриктурах желчных протоков и составляют, по нашим данным, 16,5 %.
Показаниями к созданию билио-билиарных анастомозов являются рубцовые стриктуры желчных протоков, поражающие более 2/з окружности, то есть стриктуры, не подлежащие операциям типа Гейнеке—Микулича. Протяженность стриктуры определяет принципиальный характер вмешательства. Лучше ориентироваться по расстоянию между проксимальным и дистальным концами после иссечения рубца в пределах здоровых тканей. Обычно при диастазе более 30 мм создание билио-билиарного анастомоза, даже несмотря на мобилизацию двенадцатиперстной кишки по Ко-херу, невозможно без натяжения по линии швов, что создает угрозу недостаточности соустья и впоследствии — рецидива более грубой стриктуры. Таким образом, диастаз не должен превышать 30 мм. При большем диастазе дистальный конец протока перевязывают и выполняют реконструктивную операцию.
Такую же тактику применяют и при свежих повреждениях желчных протоков, когда иссекают часть наружных желчных протоков полностью.
Билио-билиарный анастомоз может быть создан при поражении любых желчных протоков, вплоть до долевых, однако эффективность вмешательства уменьшается по мере приближения анастомоза к зоне слияния долевых протоков и тем более в случае перехода на последние. В связи с этим мы не стремимся к созданию билио-билиарных анастомозов при поражении долевых протоков, за тем редким исключением, когда диаметр их составляет 5 мм и более и удается сшить внутренние стенки без натяжения. В основном билио-билиарные анастомозы создавали при поражении печеночно-желчного протока. Обязательным условием их создания являлась полная проходимость большого сосочка двенадцатиперстной кишки. В противном случае производили коррекцию.
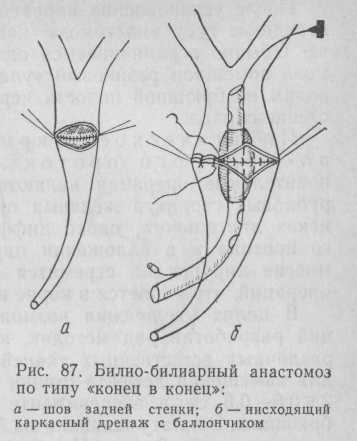
Техника операции. Вначале выделяют переднюю поверхность и боковые края суженного участка. Не следует пытаться сразу отделить и заднюю поверхность стриктуры от воротной вены из-за опасности ее повреждения. Надо вскрыть печеночно-желчный проток и рассечь его вдоль всего участка, намеченного для резекции. Разрез должен проксимально и дистально захватывать проходимые сегменты протока. Вскрытие проксимального отдела сопровождается выделением желчи и мелких камней. Через образовавшееся отверстие зондом исследуют печеночные протоки и удаляют остатки замазкообразной желчи. Затем тонким металлическим зондом проверяют проходимость суженной части. Если проходимость имеется, то переднюю поверхность рубцовой части вскрывают по зонду, и поиски дистального отдела протока не представляют особых трудностей. Если рубцовый участок непроходим, находят начало дистального отдела, который обычно имеет гораздо меньший диаметр и не содержит желчи. Иногда поиски его не приносят успеха, но на ретроградной дооперацион-ной холангиограмме определяется достаточная его длина. В этих редких случаях можно проводить эластический зонд в общий желчный проток со стороны большого сосочка двенадцатиперстной кишки, одновременно выполняя и папиллосфинктеротомию. Обнаружив тем или иным способом дистальный отдел общего желчного протока, следует сразу же оценить возможность сближения концов протока и в принципе решить вопрос о создании билио-билиарного анастомоза. После обнаружения дистального отдела общего желчного протока его вскрывают на небольшом протяжении и убеждаются в проходимости большого сосочка двенадцатиперстной кишки.
Если создание билио-билиарного анастомоза необходимо у места вскрытия обоих концов желчного протока в поперечном направлении, перерезают его переднюю стенку, а затем под контролем зрения и пальца, введенного в сальниковое отверстие, медленными пилящими движениями скальпеля на тех же уровнях пересекают и заднюю стенку протока. Затем верхний край удаляемой части протока захватывают зажимом и натягивают кпереди. Постепенно продвигаясь сверху вниз, разделяют ножницами или скальпелем сращения между протоком и воротной веной. Если участок стриктуры небольшой (до 10 мм) и имеет просвет, а задняя стенка протока мало изменена, то можно оставить небольшой мостик ткани в этой области, но явно измененные ткани следует удалить.
Оба конца желчного протока еще раз промывают и вновь оценивают возможность создания анастомоза без натяжения. Если мобилизация двенадцатиперстной кишки выполнена правильно и достаточно тщательно, то сопоставление концов протока удается без труда даже в тех случаях, когда резецирована часть печеночно-желчного протока длиной 30 мм. Необходимо подчеркнуть, что дистальную культю общего желчного протока следует мобилизовать вместе с панкреатодуоденальным комплексом, а не пытаться выделить ее из ткани поджелудочной железы, что опасно вследствие де-васкуляризации протока и последующего рубцового сморщивания.
Поскольку при стриктурах нижняя культя протока обычно уже верхней, мы делаем дополнительные продольные разрезы в боковых стенках протока в 5—8 мм от линии пересечения. При одинаковых диаметрах дистального и проксимального протоков мы стараемся увеличить их на 5—7 мм, надсекая в продольном направлении. Таким образом анастомоз становится значительно шире (в послеоперационный период наблюдается стенозирование анастомоза до 1/2 и даже 3/4 его первоначального диаметра).
После этого приступают к созданию анастомоза по типу «конец в конец». Прежде всего сшивают заднюю стенку отдельными стежками тонких нитей из рассасывающегося материала или синтетическими нитями на атравматической игле (рис. 87, а). Швы накладывают узелками наружу по типу сосудистого шва. После сшивания задней стенки в просвете протока устанавливают каркасный дренаж. При создании билио-билиарного анастомоза по типу «конец в конец» такие дренажи являются обязательными. У 11 из 13 больных мы применили нисходящий дренаж как наименее травматичный. Управляемость дренажа обеспечивали фиксирующей нитью, а достижение максимально широкого анастомоза— применением раздувного баллона (рис. 87, б). При создании такого же анастомоза на уровне слияния долевых печеночных протоков или на одном из них мы применяли дренирование в первом случае по Smith и во втором — по Snypol в наших модификациях в связи с необходимостью длительного дренирования. Перспективным является использование каркасного сетчатого дренажа из танталовой проволоки.
После установления каркасного дренажа накладываем шов на переднюю губу анастомоза, как при операции Гейнеке—Микулича. Обычно ограничиваемся одним рядом швов. У линии анастомоза помещаем резиновый «улавливающий» дренаж, который выводим из брюшной полости через отдельный прокол на брюшной стенке справа.
Пластическое закрытие дефектов печеночно-желчного протока. Как уже было сказано, восстановительные операции являются идеальным вариантом лечения Рубцовых стриктур желчных протоков. Сложность состоит в поисках дистального, плохо дифференцирующегося отдела желчного протока и в наложении циркулярного шва. В связи с этим многие хирурги не стремятся к выполнению восстановительных операций, что является в корне неправильным.
В целях увеличения возможностей восстановительных операций разработан ряд методик, предусматривающих использование различных естественных тканей. Так, Larsen и соавторы (1980) для замещения дефекта стенки желчного протока размером 1,5— 2X0,6—0,8 см в эксперименте на собаках использовали листок брюшины. Заплату вшивали на Т-образном дренаже, который удаляли через 6—8 нед. Через 1 год после операции со стороны просвета протока отмечалась ровная слизистая оболочка без рубцов. Трансплантат уменьшился и составлял 10 первоначального размера.
Пластику желчного протока участком стенки тощей кишки применили у 3 больных Landes и соавторы (1980). Методика операции заключалась в следующем. Продольным разрезом по противобрыжеечному краю вскрывали кишку на небольшом протяжении и выкраивали лоскут, сохраняя связь с сосудами брыжейки. Проходимость кишки восстанавливали анастомозом «конец в конец», а трансплантат на сосудистой ножке подводили к желчному протоку и вшивали в дефект его стенки. Хорошие результаты отмечены через 1—3 года после операции у всех больных.
Для закрытия больших дефектов печеночно-желчного протока мы использовали висцеральную поверхность стенки кишки, выключенной из пищеварения по Ру или Брауну. Обязательным условием в этом случае является полная проходимость большого сосочка двенадцатиперстной кишки (при необходимости выполняем папиллосфинктеротомию). Кишку подшиваем без натяжения поочередно к задней боковой и передне-боковой стенкам дефекта серо-серозными одиночными швами с промежутками между ними 1,5 мм. Как правило, закрытие дефекта трудностей не представляет. Этот способ позволяет создать естественный пассаж желчи с сохранением запирательной функции сфинктера печеночно-поджелудочной ампулы (рис. 88).
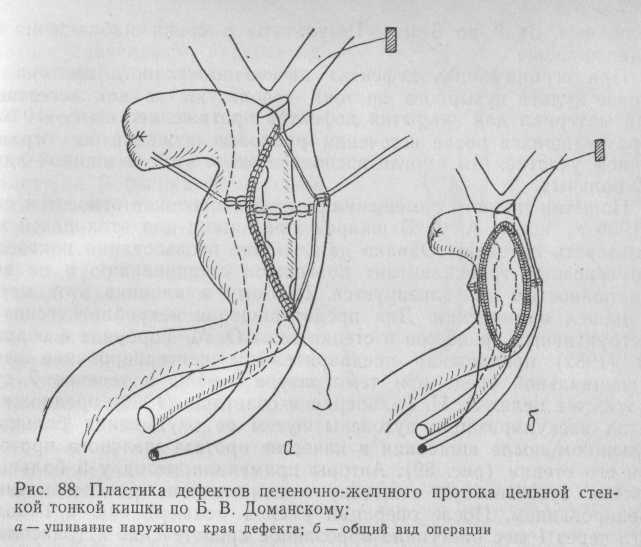
Пластику осуществляем на нисходящем дренаже, фиксированном нитью. Как показал опыт 3 операций подобного типа, размеры дефекта не влияют на техническое выполнение операции. Таким образом нам удавалось закрывать дефекты протяженностью 30—40 мм, полностью сохраняя конфигурацию желчных протоков. Каркасное дренирование про-
должалось от 3 до 6 мес. Результаты в сроки наблюдения до 5 лет хорошие.
При ограниченных дефектах печеночно-желчного протока на уровне культи пузырного протока используют ее как естественный материал для закрытия дефектов протяженностью 5—10 мм, образовавшихся после иссечения рубцовых сужений на ограниченном участке. Мы смогли воспользоваться этой методикой лишь у 2 больных.
Попытки полного замещения желчных протоков относятся еще к 1909 г., когда А. Ф. Башкиров предложил для этих целей использовать аутовену. Однако дальнейшие исследования показали, что венозный трансплантант подвержен сморщиванию и не всегда полностью эпителизируется. Поэтому в клинике этот метод не нашел применения. Для предотвращения некробиотических и деструктивных процессов в стенке вены О. М. Горбунов и соавторы (1982) предложили предварительное консервирование вены в специальной среде при температуре 3—4 °С в течение 7 сут. В этих же целях Э. И. Гальперин и соавторы (1980) предложили метод васкуляризации аутовены путем ее окутывания большим сальником после вшивания в качестве протеза желчного протока или его стенки (рис. 89).
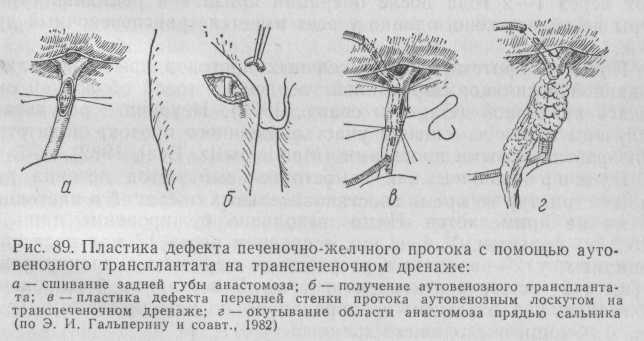
Авторы применили метод у 6 больных, сочетая аутовенозную пластику с длительным транспеченочным дренированием. После операции умер 1 больной, еще у 1 больного через 1 мес наступило аррозивное кровотечение и трансплантат был удален во время повторной операции. У остальных 4 больных через 1—2 года после операции признаков рецидива стриктуры не обнаружено, однако у всех имеется транспеченочный дренаж.
Попытка протезирования желчных протоков крыс лиофилизированной и силиконизированной твердой мозговой оболочкой оказалась неудачной (Gagni и соавт., 1979). Неудачные результаты получены и при замещении участка желчного протока политетрафлюороэтиленовыми протезами (Mendelowitz, Beal, 1982).
Бужирование как самостоятельный метод лечения Рубцовых стриктур во время восстановительных операций в настоящее время не применяется. Нами выполнено бужирование лишь 12 (15,2 %) больным. У 4 из них в среднем через 17 мес наступили рецидивы: у 2 — в связи с отсутствием каркасного дренирования и еще у 2 — с его кратковременностью. У остальных бужирование сочеталось с длительным дренированием по методике Smith (у 5) и при помощи нисходящего дренажа (у 3).
Date: 2015-09-18; view: 574; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |