
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Кристаллы — твердые тела, атомы, ионы или молекулы которых образуют упорядоченную структуру — кристаллическую решетку
Кристаллическая решетка — это схема взаимного расположения частиц в кристалле. Ее изображают в виде пространственного каркаса, образуемого пересекающимися друг с другом прямыми линиями. Точки пересечения этих прямых называют узлами решетки. В зависимости от типа связи между частицами, образующими кристаллическую решетку, различают ионные, ковалентные, металлические кристаллы. Для объяснения структур любых кристаллических решеток привлекаются представления о плотнейших упаковках шаров: кубической гранецентрированной и гексагональной.
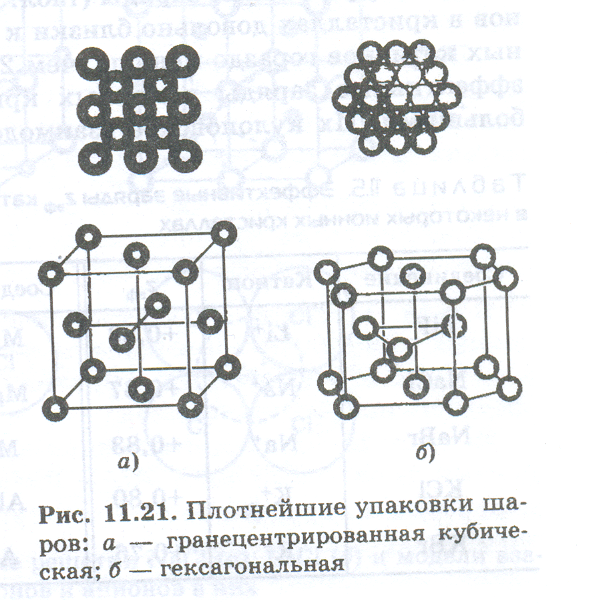
На рис. (нарисовать рисунок) вверху для каждой упаковки показан один ряд шаров, а внизу — расположение ядер атомов в кристаллической решетке. В этих упаковках каждый из шаров окружен двенадцатью другими. Степень заполнения пространства в этих двух упаковках максимальна и составляет 74,05%. Свободный объем пространства между шарами представлен тетраэдрическими и октаэдрическими полостями, в которых могут размещаться другие шары с меньшими размерами. В каждой тетраэдрической полости может располагаться шар с радиусом, равным 0,225 радиуса шаров, образующих плотнейшую упаковку. Октаэдрические полости крупнее: в них могут размещаться шары с радиусом 0,414 радиуса шаров плотнейшей упаковки.
Число ближайших к данному атому или иону соседних атомов или ионов называется его координационным числом,
Атомы, образующие кристаллы с кубической гранецентрированной и гексагональной структурами, имеют координационные числа 12.
Для аморфных веществ характерно отсутствие упорядоченной структуры. Некоторые вещества вообще не удается получить в виде кристаллов, другие наряду с кристаллическим могут существовать в аморфном стеклообразном состоянии. Физические и химические свойства кристаллической и аморфной модификаций одного и того же вещества могут существенно различаться.
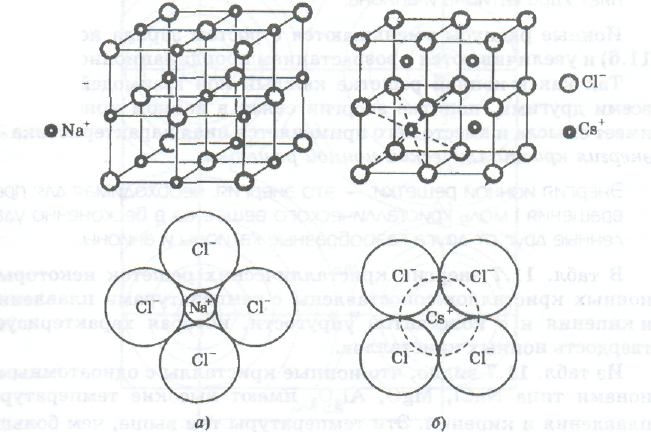
Ионные кристаллы. В узлах ионной кристаллической решетки чередуются катионы и анионы (рис. показать рисунок). Расстояния между противоположно заряженными ионами в кристаллах меньше, чем расстояния между одноименными ионами, поэтому электростатические силы межионного притяжения преобладают над силами отталкивания. Так как электростатические силы не обладают ни насыщаемостью, ни направленностью, каждый ион взаимодействует не только с ионами своего непосредственного окружения, но и со всеми другими ионами кристалла. Рассмотренная картина электростатического межионного взаимодействия не учитывает того, что валентные электроны атомов частично обобществляются и связь не является чисто ионной. Эффективные заряды однозарядных катионов в кристаллах довольно близки к 1+, а у двух- и трехзарядных катионов гораздо меньше, чем 2+ и 3+. При этом, однако, эффективные заряды в ионных кристаллах всегда остаются большими. Их кулоновское взаимодействие остается сильным и создает строго упорядоченное чередование катионов и анионов в пространстве, т. е. ионную решетку.
Date: 2015-09-18; view: 878; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |