
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

ТЕРМОХИМИЯ. закона Гесса: «Тепловой эффект химической реакции не зависит от пути протекания реакции, а зависит только от термодинамического состояния и природы исходных
закона Гесса: «Тепловой эффект химической реакции не зависит от пути протекания реакции, а зависит только от термодинамического состояния и природы исходных веществ и продуктов реакции».
Из закона Гесса вытекает ряд следствий.
1. Теплота образования (энтальпия) химического соединения представляет собой тепловой эффект образования одного моль вещества из соответствующих простых веществ.
Тепловой эффект зависит не только от природы вещества, но и его термодинамического состояния, поэтому теплоты образования определяют при стандартных условиях (Т = 298 К, р = 101,3 кПа). При этих условиях теплоту образования называют стандартной. Теплоты образования неорганических и органических веществ сведены в таблицу «Термодинамические величины простых и сложных веществ».
ΔН0298 (Al2(SO4)3) = -3434 кДж/моль;
2Al + 3S +6O2 = Al2(SO4)3 + 3434 кДж/моль.
2. Закон Лавуазье-Лапласа: «Теплота разложения химического соединения равна по абсолютной величине, но противоположна по знаку теплоте образования данного соединения».
Теплотой (энтальпией) разложения химического соединения называется тепловой эффект разложения одного моль вещества до соответствующих простых веществ.
ΔН0298 (BaCO3) = -1264 кДж/моль; ΔНразл298 (BaCO3) = 1264 кДж/моль;
BaCO3 = Ba +C +3/2O2 – 1264 кДж/моль.
3. Тепловой эффект химической реакции равен разности между суммой теплот образования продуктов реакции и сумой теплот образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции.
ΔН0298 (х.р.) = Σ ni ΔН0298 (прод) - Σ ni ΔН0298 (исх).
4. Теплотой (энтальпией) сгорания химического соединения называется количество теплоты, которое выделяется при сгорании одного моль вещества до соответствующих оксидов.
Продукты сгорания веществ указаны в таблице «Теплоты сгорания органических веществ».
а) ΔНсг298 (С2Н2) = - 1299,63 кДж/моль;
С2Н2 + 5/2О2 → 2СО2 + Н2О + 1299,63 кДж/моль.
б) ΔНсг298 (С6Н5Cl) = - 726,64 кДж/моль;
С6Н5Cl + 7О2 → 6СО2 + 2Н2О+ HCl + 726,64 кДж/моль.
5. Теплота образования органического соединения равна разности между суммой теплот сгорания простых веществ и теплотой сгорания органического вещества с учетом стехиометрических коэффициентов в уравнении реакции.
C + 2H2 + O2 = CH3OH; ΔН0298 (CH3OH) =?
ΔНсг298 (С) = ΔН0298 (CO2) = -393,51 кДж/моль;
ΔНсг298 (H2) = ΔН0298 (H2Oж) = -285,84 кДж/моль;
ΔН0298 (CH3OH) = ΔНсг298 (С) + 2 ΔНсг298 (H2) – ΔНсг298 (CH3OH) =
-393,51 + 2(-285,84) + 726,64 = -238,55 кДж/моль.
6. Тепловой эффект химической реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
ΔН0298 (х.р.) = Σ ni ΔНсг298 (исх) - Σ ni ΔНсг298 (прод).
Если в таблицах стандартных термодинамических величин отсутствуют данные по теплотам образования или теплотам сгорания, то тепловой эффект реакции может быть рассчитан по энергиям связей.
7. Тепловой эффект реакции, протекающей в газовой фазе, равен разности между суммой энергий связей в молекулах исходных веществ и суммой энергий связей в молекулах продуктов реакции.
8. Тепловой эффект сгорания жидкого вещества равен разности между суммой теплоты испарения и энергий связей исходного вещества и суммой теплоты испарения и энергий связей продуктов реакции.
9. Если совершаются две или несколько реакций из разных исходных состояний к одинаковым конечным, то разница между тепловыми эффектами этих реакций представляет собой тепловой эффект перехода из одного исходного состояния в другое.
Сгр + О2 → СО2; δНо298 = -393.5кДж/моль
Салм + О2 → СО2; δНо298 = -395.4 кДж/моль
Сгр →Салм; δНо298 = 1.9 кДж/моль
10. Если совершаются две или несколько реакций из одинаковых исходных состояний в различные конечные, то разница между тепловыми эффектами этих реакций представляет собой тепловой эффект перехода из одного конечного состояний в другое.
СН3ОН → СН2О; δНо298 = 122,8 кДж/моль
СН3ОН → НСО2Н; δНо298 = -184,1 кДж/моль
СН2О → НСО2Н; δНо298 = -306,9 кДж/моль
11. Теплота (энтальпия) нейтрализации – это количество теплоты, которое выделяется при нейтрализации одного моль эквивалента кислоты одним моль эквивалента основания.
Сущность реакции нейтрализации сильной кислоты сильным основанием:
Н+ + ОН- = Н2О; Δ H0нейтр = -57,3 кДж/моль.
При нейтрализации слабой кислоты сильным основанием или наоборот слабого основания сильной кислотой теплота нейтрализации будет меньше, потому что часть теплоты будет расходоваться на диссоциацию слабого электролита.
12. Теплота (энтальпия) растворения – это количество теплоты, которое выделяется при растворении одного моль веществ в таком объеме воды, дальнейшее прибавление которой не вызывает изменения теплового эффекта.
Теплота растворения равна сумме теплоты диссоциации и теплоты гидратации:
Δ Hраств = Δ Hдис + Δ Hгидр
Теплотой диссоциации называется количество теплоты, которое поглощается при полной диссоциации одного моль вещества. Теплотой гидратации называется количество теплоты, которое выделяется при полной гидратации одного моль вещества. Растворение идет с выделением теплоты, если Δ Hгидр > Δ Hдис, и с поглощением теплоты, если Δ Hгидр < Δ Hдис.
| № по порядку | Вещество | δНо f. 298 . Кдж/моль | Sо 298 . дж/моль∙град | Теплоемкость. дж/моль∙град | δНо f. 298 . Ккал/моль | Sо 298 . кал/моль∙град | Теплоемкость. кал/моль∙град | Температурный интервал. оК | |||||||
Коэффициенты уравнения
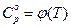
| 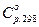
|
Коэффициенты уравнения
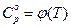
| 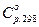
| ||||||||||||
| а | b ∙103 | c’ ∙10-5 | |||||||||||||
| а | b ∙103 | c’ ∙10-5 | |||||||||||||
| 1. | Ag (кр.) | 42.69 | 23.97 | 5.28 | -0.25 | 25.48 | 10.20 | 5.73 | 1.26 | -0.06 | 6.09 | 273—1234 | |||
| 2. | Al (кр.) | 28.31 | 20.67 | 12.39 | — | 24.34 | 6.77 | 4.94 | 2.96 | — | 5.82 | 298—933 | |||
| 3. | As (кр.) | 35.1 | 21.9 | 9.29 | — | 24.64 | 8.4 | 5.23 | 2.22 | — | 5.89 | 298—1100 | |||
| 4. | Au (кр.) | 47.45 | 23.68 | 5.19 | — | 25.23 | 11.34 | 5.66 | 1.24 | — | 6.03 | 298—1336 | |||
| 5. | B (кр.) | 5.87 | 6.44 | 18.4 | — | 11.96 | 1.40 | 1.54 | 4.40 | — | 2.86 | 273—1200 | |||
| 6. | Ba-a | (64.9) | 22.26 | 13.8 | — | 26.36 | (15.52) | 5.32 | 3.30 | — | 6.30 | 298—643 | |||
| 7. | Ba-b | — | — | 1.45 | 29.3 | — | — | — | — | 2.50 | 7.00 | — | — | 643—983 | |
| 8. | Be (кр.) | 9.54 | 19.0 | 8.87 | -3.43 | 16.44 | 2.28 | 4.54 | 2.12 | -0.82 | 3.93 | 298—1173 | |||
| 9. | Bi (кр.) | 56.9 | 18.79 | 22.59 | — | 25.52 | 13.6 | 4.49 | 5.40 | — | 6.10 | 298—544 | |||
| 10. | Br2 (ж.) | 152.3 | — | — | — | 75.71 | 36.4 | — | — | — | 18.10 | ||||
| 11. | Br2 (г.) | 30.92 | 245.35 | 37.20 | 0.71 | -1.19 | 36.0 | 7.39 | 58.64 | 8.89 | 0.17 | -0.28 | 8.60 | 298—1500 | |
| 12. | C (алмаз) | 1.897 | 2.38 | 9.12 | 13.22 | -6.19 | 6.07 | 0.453 | 0.568 | 2.18 | 3.16 | -1.48 | 1.45 | 298—1200 | |
| 13. | C (графит) | 5.74 | 17.15 | 4.27 | -8.79 | 8.53 | 1.37 | 4.10 | 1.02 | -2.10 | 2.04 | 298—2300 | |||
| 14. | Ca-a | 41.62 | 22.2 | 13.9 | — | 26.28 | 9.95 | 5.31 | 3.33 | — | 6.28 | 273—713 | |||
| 15. | Cda | 51.76 | 22.22 | 12.30 | — | 25.90 | 12.37 | 5.31 | 2.94 | — | 6.19 | 273—594 | |||
| 16. | Cl (г.) | 121.3 | 165.09 | 23.14 | -0.67 | -0.96 | 21.84 | 29.0 | 39.46 | 5.53 | -0.16 | -0.23 | 5.22 | 298—2000 | |
| 17. | Cl2 (г.) | 223.0 | 36.69 | 1.05 | -2.52 | 33.84 | 53.30 | 8.77 | 0.25 | -0.60 | 8.09 | 273—1500 | |||
| 18. | Co-a | 30.04 | 21.38 | 14.31 | -0.88 | 24.6 | 7.18 | 5.11 | 3.42 | -0.21 | 5.88 | 298—650 | |||
| 19. | Cr (кр.) | 23.76 | 24.43 | 9.87 | -3.68 | 23.35 | 5.68 | 5.84 | 2.36 | -0.88 | 5.58 | 298—1823 | |||
| 20. | Cs (кр.) | 84.35 | — | — | — | 31.4 | 20.16 | — | — | — | 7.50 | 298—303 | |||
| 21. | Cu (кр.) | 33.30 | 22.64 | 6.28 | — | 24.51 | 7.96 | 5.41 | 1.50 | — | 5.86 | 298—1356 | |||
| 22. | D (г.) | 221.68 | 123.24 | — | — | — | 20.79 | 52.98 | 29.46 | — | — | — | 4.97* | — | |
| 23. | D2 (г.) | 144.9 | 27.40 | 4.30 | -0.40 | 29.20 | 34.60 | 6.55 | 1.03 | -0.096 | 6.98 | 500—2000 | |||
| 24. | F2 (г.) | 202.9 | 34.69 | 1.84 | -3.35 | 31.32 | 48.6 | 8.29 | 0.44 | -0.80 | 7.49 | 273—2000 | |||
| 25. | Fe-a | 27.15 | 19.25 | 21.0 | — | 25.23 | 6.49 | 4.60 | 5.02 | — | 6.03 | 298—700 ** | |||
| 26. | Ga (кр.) | 41.09 | — | — | — | 26.10 | 9.8 | — | — | — | 6.24 | ||||
| 27. | Ge (кр.) | 42.38 | 23.8 | 16.8 | — | (28.8) | 10.1 | 5.69 | 4.02 | — | (6.88) | 298—1213 | |||
| 28. | H (г.) | 217.9 | 114.6 | — | — | — | 20.79 | 52.09 | 27.39 | — | — | — | 4.97* | — | |
| 29. | H2 (г.) | 130.6 | 27.28 | 3.26 | 0.502 | 28.83 | 31.21 | 6.52 | 0.78 | 0.12 | 6.89 | 298—3000 | |||
| 30. | HD (г.) | 0.155 | 143.7 | 25.93 | 4.50 | 2.80 | 29.20 | 0.037 | 34.34 | 6.19 | 1.08 | 0.67 | 6.98 | 500—2000 | |
| 31. | Hg (ж.) | 76.1 | — | — | — | 27.82 | 18.2 | — | — | — | 6.65 | ||||
| 32. | Hg (г.) | 60.83 | 174.9 | — | — | — | 20.79 | 14.54 | 41.80 | — | — | — | 4.97* | — | |
| 33. | J2 (кр.) | 116.73 | 40.12 | 49.79 | — | 54.44 | 27.9 | 9.59 | 11.90 | — | 13.01 | 298—387 | |||
| 34. | J2 (г.) | 62.24 | 260.58 | 37.40 | 0.59 | -0.71 | 36.9 | 14.88 | 62.28 | 8.94 | 0.14 | -0.17 | 8.82 | 298—3000 | |
| 35. | In (кр.) | (58.1) | 20.26 | 21.6 | — | 26.7 | (13.9) | 4.84 | 5.16 | — | 6.39 | 298— 430 | |||
| 36. | К (кр.) | 64.35 | — | — | — | 29.96 | 15.38 | — | — | — | 7.18 | 298—336 | |||
| 37. | Li (кр.) | 28.03 | 12.76 | 35.98 | — | 23.64 | 6.70 | 3.05 | 8.60 | — | 5.65 | 273—454 | |||
| 38. | Mg (кр.) | 32.55 | 22.3 | 10.64 | -0.42 | 24.8 | 7.78 | 5.33 | 2.54 | -0.10 | 5.93 | 298—923 | |||
| 39. | Мn-a | 31.76 | 23.85 | 14.14 | -1.59 | 26.32 | 7.59 | 5.70 | 3.38 | -0.38 | 6.29 | 298—1000 | |||
| 40. | Мо (кр.) | 28.58 | 22.93 | 5.44 | — | 23.75 | 6.83 | 5.48 | 1.30 | — | 5.68 | 298—1800 | |||
| 41. | N2 (г.) | 191.5 | 27.87 | 4.27 | — | 29.10 | 45.77 | 6.66 | 1.02 | — | 6.96 | 298—2500 | |||
| 42. | Na (кр.) | 51.42 | 20.92 | 22.43 | — | 28.22 | 12.29 | 5.0 | 5.36 | — | 6.74 | 298—371 | |||
| 43. | Ni-a | 29.86 | 16.99 | 29.46 | — | 20.05 | 7.14 | 4.06 | 7.04 | — | 6.20 | 298—630 | |||
| 44. | O (г.) | 247.4 | 160.95 | — | — | — | 21.90 | 59.1 | 38.47 | — | — | — | 5.24 | ||
| 45. | O2 (г.) | 205.03 | 31.46 | 3.39 | -3.77 | 29.36 | 49.00 | 7.52 | 0.81 | -0.90 | 7.02 | 298—3000 | |||
| 46. | O3 (г.) | 142.3 | 238.8 | 47.03 | 8.03 | -9.04 | 39.20 | 34.0 | 57.07 | 11.23 | 1.92 | -2.16 | 9.37 | 298—1000 | |
| 47. | Р (бел.) | 44.35 | — | — | — | 23.22 | 10.6 | — | — | — | 5.55 | 273—317 | |||
| 48. | Р (красн.) | -18.41 | (22.8) | 19.83 | 16.32 | — | 20.83 | -4.4 | (5.46) | 4.74 | 3.90 | — | 4.98 | 298—800 | |
| 49. | P2 (г.). | 141.5 | 218.1 | 35.86 | 1.15 | -3.68 | 31.92 | 33.8 | 52.1 | 8.57 | 0.28 | -0.88 | 7.63 | 273—2000 | |
| 50. | Рb (кр.) | 64.9 | 23.93 | 8.70 | — | 26.82 | 15.5 | 5.72 | 2.08 | — | 6.41 | 273—600 | |||
| 51. | Pt (кр.) | 41.8 | 24.02 | 5.61 | — | 26.57 | 10.0 | 5.74 | 1.34 | — | 6.35 | 298—1800 | |||
| 52. | Rb (кр.) | (76.2) | — | — | — | 30.42 | (18.2) | — | — | — | 7.27 | 273—312 | |||
| 53. | S(монокл.) | 0.30 | 32.55 | 14.90 | 29.08 | — | 23.64 | 0.07 | 7.78 | 3.56 | 6.95 | — | 5.65 | 368—392 | |
| 54. | S (ромб.) | 31.88 | 14.98 | 26.11 | — | 22.60 | 7.62 | 3.58 | 6.24 | — | 5.40 | 273-368.6 | |||
| 55. | S2 (г.) | (129.1) | 227.7 | 36.11 | 1.09 | -3.52 | 32.47 | (30.9) | 54.4 | 8.63 | 0.26 | -0.84 | 7.77 | 273—2000 | |
| 56. | Sb (кр.) | (45.69) | 23.1 | 7.28 | — | 25.43 | (10.92) | 5.52 | 1.74 | — | 6.08 | 298—903 | |||
| 57. | Se (кр.) | 42.44 | 18.95 | 23.01 | — | 25.36 | 10.15 | 4.53 | 5.50 | — | 6.06 | 273—493 | |||
| 58. | Si (кр.) | 18.72 | 24.02 | 2.58 | -4.23 | 19.8 | 4.5 | 5.74 | 0.62 | -1.01 | 4.73 | 273—1174 | |||
| 59. | Sn (бел.) | 51.4 | 18.49 | 26.36 | — | 26.36 | 12.3 | 4.42 | 6.30 | — | 6.30 | 273—505 | |||
| 60. | Sr (кр.) | 54.4 | 23.43 | 5.73 | — | 25.1 | 13.0 | 5.60 | 1.37 | — | 6.0 | 298—508 | |||
| 61. | Те (кр.) | 49.71 | 23.8 | 6.28 | — | 25.6 | 11.88 | 5.69 | 1.5 | — | 6.11 | 273—620 | |||
| 62. | Th (кр.) | 53.39 | 21.67 | 19.0 | — | 27.33 | 12.76 | 5.18 | 4.54 | — | 6.53 | 298—1500 | |||
| 63. | Тi-a | 30.66 | 22.09 | 10.04 | — | 25.0 | 7.33 | 5.28 | 2.4 | — | 5.98 | 298—1155 | |||
| 64. | Тl-a | 64.22 | 22.01 | 14.48 | — | 26.40 | 15.35 | 5.26 | 3.46 | — | 6.3 | 273—505 | |||
| 65. | U (кр.) | 50.33 | 14.18 | 33.56 | 2.93 | 27.5 | 12.03 | 3.39 | 8.02 | 0.7 | 6.57 | 298—935 | |||
| 66. | W (кр.) | 32.76 | 24.02 | 3.18 | — | 24.8 | 7.8 | 5.74 | 0.76 | — | 5.93 | 273—2000 | |||
| 67. | Zn (кр.) | 41.59 | 22.38 | 10.04 | — | 25.48 | 9.94 | 5.35 | 2.4 | — | 6.09 | 273—693 | |||
| 68. | Zr-a | 38.9 | 28.58 | 4.69 | -3.81 | 25.15 | 9.3 | 6.83 | 1.12 | -0.91 | 6.01 | 298—1135 | |||
| 69. | AgВr (кр.) | -99.16 | 107.1 | 33.18 | 64.43 | — | 52.38 | -23.7 | 25.6 | 7.93 | 15.40 | — | 12.52 | 298—691 | |
| 70. | AgCl (кр.) | -126.8 | 96.07 | 62.26 | 4.18 | -11.30 | 50.78 | -30.3 | 22.96 | 14.88 | 1.00 | -2.70 | 12.14 | 273—725 | |
| 71. | AgJ-a | (-64.2) | 114.2 | 24.35 | 100.8 | — | 54.43 | (-15.34) | 27.3 | 5.82 | 24.10 | — | 13.01 | 273—423 | |
| 72. | AgNO3-a | -120.7 | 140.9 | 36.65 | 189.1 | — | (93.05) | -28.85 | 33.68 | 8.76 | 45.2 | — | (22.24) | 273—433 | |
| 73. | Ag2O (кр.) | -30.56 | 121.7 | 55.48 | 29.46 | — | 65.56 | -7.30 | 29.1 | 13.26 | 7.04 | — | 15.67 | 298—500 | |
| 74. | Ag2S-a | (-33.2) | (140.6) | 42.38 | 110.5 | — | 75.31 | (-7.93) | (33.6) | 10.13 | 26.4 | — | 18.0 | 273—448 | |
| 75. | Ag2SО4(кр.) | -713.1 | 199.9 | 96.7 | — | 131.4 | -170.4 | 47.8 | 23.1 | 27.9 | — | 31.4 | 298—597 | ||
| 76. | А1Вг3 (кр.) | -526.2 | 78.41 | 78.08 | — | 102.5 | -125.76 | 44.0 | 18.74 | 18.66 | — | 24.5 | 298—370 | ||
| 77. | AICl (кр.) | -697.4 | 167.0 | 55.44 | 117.15 | — | 89.1 | -166.8 | 39.9 | 13.25 | 28.0 | — | 21.3 | 273—453 | |
| 78. | AlF3-a | -1488 | 66.48 | 72.26 | 45.86 | -9.62 | 75.10 | -355.8 | 15.9 | 17.27 | 10.96 | -2.30 | 17.95 | 298—727 | |
| 79. | Аl2O3 (корунд) | -1675 | 50.94 | 114.56 | 12.89 | -34.31 | 79.0 | -400.3 | 12.18 | 27.38 | 3.08 | -8.20 | 18.88 | 298—1800 | |
| 80. | A12 (SO4) (кр.) | -3434 | 239.2 | 366.3 | 62.6 | -111.6 | 259.3 | -821.0 | 57.2 | 87.55 | 14.96 | -26.88 | 62.0 | 298—1100 | |
| 81. | AsCI3 (г.) | -299.2 | 327.2 | 82.1 | 1.00 | -5.94 | 75.7 | -71.5 | 78.2 | 19.62 | 0.24 | -1.42 | 18.1 | 298—2000 | |
| 82. | As2O3 (кр.) | (-656.8) | 107.1 | 35.02 | 203.3 | — | 95.65 | (-157.1) | 25.6 | 8.37 | 48.6 | — | 22.86 | 273—548 | |
| 83. | As2O5 (кр.) | -918.0 | 105.4 | — | — | — | 117.5 | -219.4 | 25.2 | — | — | — | 28.1 | ||
| 84. | ВС13 (г.) | -395.4 | 289.8 | 70.54 | 11.97 | -10.21 | 62.63 | -94.50 | 69.26 | 16.86 | 2.86 | -2.44 | 14.97 | 298—1000 | |
| 85. | BF3 (г.) | -1110 | 254.2 | 52.05 | 28.03 | -8.87 | 50.53 | -265.3 | 60.75 | 12.44 | 6.70 | -2.12 | 12.08 | 298—1000 | |
| 86. | В2O3 (кр.) | -1264 | 53.85 | 36.53 | 106.3 | -5.48 | 62.97 | -302 | 12.87 | 8.73 | 25.41 | -1.31 | 15.05 | 298—723 | |
| 87. | ВаСО3 (кр.) | -1202 | 112.1 | 86.90 | 49.0 | -11.97 | 85.35 | -287.3 | 26.8 | 20.77 | 11.7 | -2.86 | 20.4 | 273—1040 | |
| 88. | ВаС12 (кр.) | -859.8 | 125.5 | 71.13 | 13.97 | — | 75.3 | -205.5 | 30.0 | 17.0 | 3.34 | — | 18.0 | 273—1198 | |
| 89. | Ва(NO3)2 (кр.) | -991.6 | 213.7 | 125.7 | 149.4 | -16.78 | 150.9 | -237.0 | 51.07 | 30.0 | 35.7 | -4.01 | 36.07 | 298—850 | |
| 90. | ВаО (кр.) | -556.6 | 70.3 | 53.30 | 4.35 | -8.30 | 47.23 | -133.0 | 16.8 | 12.74 | 1.04 | -1.98 | 11.29 | 298—1270 | |
| 91. | Ва(ОН)2 (кр.) | -946.1 | 103.8 | 70.7 | 91.6 | — | 97.9 | -226.1 | 24.8 | 16.9 | 21.9 | — | 23.4 | 298—680 | |
| 92. | BaSO4 (кр.) | -1465 | 131.8 | 141.4 | — | -35.27 | 101.8 | -350.2 | 31.5 | 33.8 | — | -8.43 | 24.3 | 273—1300 | |
| 93. | ВеО (кр.) | (-598.7) | 14.10 | 35.36 | 16.74 | -13.26 | 25.4 | (-143.1) | 3.37 | 8.45 | 4.00 | -3.17 | 6.07 | 273—1175 | |
| 94. | BeSO4 (кр.) | -1196 | 90.0 | — | — | — | -286.0 | 21.5 | — | — | — | ||||
| 95. | Bi2O3 (кр.) | -578.0 | 151.2 | 103.51 | 33.47 | — | 113.5 | -138.1 | 36.1 | 24.74 | 8.00 | — | 27.1 | 298—800 | |
| 96. | СО (г.) | -110.5 | 197.4 | 28.41 | 4.10 | -0.46 | 29.15 | -26.41 | 47.18 | 6.79 | 0.98 | -0.11 | 6.97 | 298—2500 | |
| 97. | СO2 (г.) | -393.51 | 213.6 | 44.14 | 9.04 | -8.53 | 37.13 | -94.05 | 51.06 | 10.55 | 2.16 | -2.04 | 8.87 | 298—2500 | |
| 98. | СОС12 (г.) | -223.0 | 289.2 | 67.16 | 12.11 | -9.03 | 60.67 | -53.3 | 69.13 | 16.05 | 2.89 | -2.16 | 14.50 | 298—1000 | |
| 99. | COS (г.) | -137.2 | 231.5 | 48.12 | 8.45 | -8.20 | 41.63 | -32.8 | 55.33 | 11.50 | 2.02 | -1.96 | 9.95 | 298—1800 | |
| 100. | CS2 (ж.) | 87.8 | 151.0 | — | — | — | 75.65 | 21.0 | 36.1 | — | — | — | 18.08 | ||
| 101. | CS2 (г.) | 115.3 | 237.8 | 52.09 | 6.69 | -7.53 | 45.65 | 27.55 | 56.84 | 12.45 | 1.60 | -1.80 | 10.91 | 298—1800 | |
| 102. | CaC2-a | -62.7 | 70.3 | 68.62 | 11.88 | -8.66 | 62.34 | -15.0 | 16.8 | 16.4 | 2.84 | -2.07 | 14.9 | 298—720 | |
| 103. | СаСО3(кальцит) | -1206 | 92.9 | 104.5 | 21.92 | -25.94 | 81.85 | -288.2 | 22.2 | 24.98 | 5.24 | -6.20 | 19.56 | 298-1200 | |
| 104. | СаС12 (кр.) | (-785.8) | 113.8 | 71.88 | 12.72 | -2.5 | 72.61 | (-187.8) | 27.2 | 17.18 | 3.04 | -0.60 | 17.36 | 298—1055 | |
| 105. | CaF2-a | -1214 | 68.87 | 59.83 | 30.46 | 1.96 | 67.03 | -290.2 | 16.46 | 14.3 | 7.28 | 0.47 | 16.02 | 298—1000 | |
| 106. | Ca(NО3)2 (кр.) | -936.9 | 193.2 | 122.9 | -17.28 | 149.4 | -223.9 | 46.2 | 29.37 | 36.80 | -4.13 | 35.7 | 298-800 | ||
| 107. | СаО (кр.) | -635.1 | 39.7 | 49.63 | 4.52 | -6.95 | 42.80 | -151.8 | 9.5 | 11.86 | 1.08 | -1.66 | 10.23 | 298—1800 | |
| 108. | Са(ОН)2 (кр.) | - 986.2 | (83.4) | 105.2 | 12.0 | -19.0 | 87.5 | -235.7 | (19.9) | 25.14 | 2.87 | -4.54 | 20.9 | 298—600 | |
| 109. | СаНРО4 (кр.) | -1820 | — | — | — | — | -435.0 | — | — | — | — | — | |||
| 110. | СаНРО4∙2Н2О (кр.) | -2409 | — | — | — | 97.1 | -575.8 | — | — | — | 23.2 | ||||
| 111. | Са(Н2РО4)2 (кр.) | -3114.5 | 189.5 | — | — | — | — | -744.4 | 45.3 | — | — | — | — | — | |
| 112. | Са(Н2РО4)2∙Н2О (кр.) | -3418 | (259.8) | — | — | — | 259.2 | -817 | (62.10) | — | — | — | 62.0 | ||
| 113. | Са3(РО4)2-a | -4125 | 240.9 | 201.8 | -20.92 | 231.6 | -985.9 | 57.6 | 48.24 | 39.68 | -5.0 | 55.4 | 298—1373 | ||
| 114. | CaS (кр.) | - 478.3 | 56.5 | 42.68 | 15.90 | — | 47.40 | -114.3 | 13.5 | 10.2 | 3.8 | — | 11.33 | 273—1000 | |
| 115. | CaSO4 (ангидрит) | -1424 | 106.7 | 70.21 | 98.74 | — | 99.66 | -340 | 25.5 | 16.78 | 23.60 | — | 23.29 | 299—1400 | |
| 116. | CdCl2 (кр.) | -389.0 | 115.3 | 61.25 | 40.17 | — | 73.22 | -93.0 | 27.56 | 14.64 | 9.60 | — | 17.50 | 273—841 | |
| 117. | CdO (кр.) | -256.1 | 54.8 | 40.38 | 8.70 | — | 43.43 | -61.2 | 13.1 | 9.65 | 2.08 | — | 10.18 | 273—1200 | |
| 118. | CdS (кр.) | -144.3 | 71.0 | 54.0 | 3.8 | — | 55.2 | -34.5 | 17.0 | 12.9 | 0.90 | — | 13.2 | 273—1273 | |
| 119. | CdSO4 (кр.) | -925.9 | (123.1) | 77.32 | 77.40 | — | 99.60 | -221.3 | (29.4) | 18.48 | 18.5 | — | 23.8 | 298—1273 | |
| 120. | С12О (г.) | 75.7 | 266.3 | 53.18 | 3.35 | -7.78 | 45.6 | 18.2 | 63.64 | 12.71 | 0.8 | -1.86 | 10.8 | 298—2000 | |
| 121. | СlO2 (г.) | 104.6 | 251.3 | 48.28 | 7.53 | -7.74 | 41.8 | 25.0 | 60.06 | 11.54 | 1.80 | -1.85 | 10.0 | 298—1500 | |
| 122. | CoCl2 (кр.) | -325.4 | 106.6 | 60.29 | 61.09 | — | 78.6 | -77.8 | 25.48 | 14.41 | 14.60 | — | 18.8 | 298—1000 | |
| 123. | CoSO4 (кр.) | -867.9 | 113.3 | 125.9 | 41.51 | — | -207.4 | 27.1 | 30.09 | 9.92 | — | 33.0 | 298—700 | ||
| 124. | CrCl3 (кр.) | -554.8 | 122.9 | 81.34 | 29.41 | — | 91.8 | -132.6 | 29.38 | 19.44 | 7.03 | — | 21.94 | 286—319 | |
| 125. | СrO3 (кр.) | -594.5 | — | — | — | — | -142.1 | 17.2 | — | — | — | — | — | ||
| 126. | Cr2О3 (кр.) | -1141 | 81.1 | 119.4 | 9.20 | -15.65 | 104.6 | -273 | 19.78 | 28.53 | 2.20 | -3.74 | 25.00 | 350—1800 | |
| 127. | CsCl (кр.) | -432.9 | 100.0 | 49.79 | 9.54 | — | 52.63 | -103.5 | 23.9 | 11.90 | 2.28 | — | 12.58 | 298—918 | |
| 128. | CsJ (кр.) | -336.7 | 48.53 | 11.21 | — | 51.87 | -80.5 | 11.60 | 2.68 | — | 12.40 | 298—894 | |||
| 129. | CsOH (кр.) | -406.5 | 77.8 | — | — | — | — | -97.2 | 18.6 | — | — | — | — | — | |
| 130. | CuCl (кр.) | -134.7 | 91.6 | 43.9 | 40.6 | — | 56.1 | -32.2 | 21.9 | 10.5 | 9.7 | — | 13.4 | 273—695 | |
| 131. | СuС12 (кр.) | -205.9 | 64.52 | 50.21 | — | 79.5 | -49.2 | 27.0 | 15.42 | 12.00 | — | 19.0 | 273—773 | ||
| 132. | СuО (кр.) | (-165.3) | 42.64 | 38.79 | 20.08 | — | 44.78 | (-39.5) | 10.2 | 9.27 | 4.80 | — | 10.7 | 298—1250 | |
| 133. | CuS (кр.) | -48.5 | 66.5 | 42.05 | 11.05 | — | 47.82 | -11.6 | 15.9 | 10.60 | 2.64 | — | 11.43 | 273—1273 | |
| 134. | CuSO4 (кр.) | -771.1 | 113.3 | 78.53 | 71.96 | — | 100.0 | -184.3 | 27.1 | 18.77 | 17.20 | — | 23.9 | 298—900 | |
| 135. | Сu2О (кр.) | -167.36 | 93.93 | 62.34 | 23.85 | — | 63.64 | -40.00 | 22.44 | 14.9 | 5.7 | — | 16.7 | 298—1200 | |
| 136. | Cu2S (кр.) | -82.01 | 119.24 | 39.24 | 130.54 | — | 76.24 | -19.60 | 28.50 | 9.38 | 31.2 | — | 18.7 | 298—376 | |
| 137. | D2O (г.) | -249.20 | 198.40 | — | — | — | 34.27 | -59.46 | 47.41 | — | — | — | 8.19 | ||
| 138. | D2O (ж.) | -294.61 | 72.36 | — | — | — | 82.42 | -70.41 | 17.29 | — | — | — | 19.70 | ||
| 139. | FeCO3 (кр.) | -747.68 | 92.88 | 48.66 | 112.13 | — | 82.13 | -178.70 | 22.20 | 11.63 | 26.8 | — | 19.63 | 298—855 | |
| 140. | FeO (кр.) | -263.68 | 58.79 | 52.80 | 6.24 | -3.19 | 48.12 | -63.20 | 14.05 | 12.62 | 1.492 | -0.762 | 12.20 | 298—1600 | |
| 141. | Fe2O3 (кр.) | -821.32 | 89.96 | 97.74 | 72.13 | -12.89 | 103.70 | -196.30 | 21.50 | 23.36 | 17.24 | -3.08 | 24.80 | 298—1000 | |
| 142. | Fe3O4 (кр.) | -1117.71 | 151.46 | 167.03 | 78.91 | -41.82 | 143.40 | -266.90 | 36.20 | 39.92 | 18.86 | -10.01 | 34.27 | 298—900 | |
| 143. | FeS (кр.) | -95.40 | 67.36 | 21.71 | 110.50 | — | 50.54 | -22.80 | 16.10 | 5.19 | 26.40 | — | 13.10 | 298—400 | |
| 144. | FeSO4 (кр.) | -922.57 | 107.53 | — | — | — | 100.54 | -220.50 | 25.70 | — | — | — | 24.03 | ||
| 145. | FeS2 (кр.) | -177.40 | 53.14 | 74.81 | 5.52 | -12.76 | 61.92 | -42.40 | 12.70 | 17.88 | 1.32 | -3.05 | 14.80 | 298—1000 | |
| 146. | Gа2О3 (кр.) | -1077.38 | 84.64 | — | — | — | 92.05 | -257.50 | 20.23 | — | — | — | 22.00 | ||
| 147. | GеО2 (кр.) | -539.74 | 52.30 | 46.86 | 30.0 | — | 52.09 | -129.0 | 12.50 | 11.20 | 7.17 | — | 12.45 | 298—1300 | |
| 148. | НВг (г.) | -35.98 | 198.40 | 26.15 | 5.86 | 1.09 | 29.16 | -8.6 | 47.42 | 6.25 | 1.40 | 0.26 | 6.96 | 298—1600 | |
| 149. | HCN (г.) | 130.54 | 201.79 | 39.37 | 11.30 | -6.02 | 35.90 | 31.20 | 48.23 | 9.41 | 2.70 | -1.44 | 8.58 | 298—2500 | |
| 150. | НСl (г.) | -92.30 | 186.70 | 26.53 | 4.60 | 1.09 | 29.16 | -22.06 | 44.62 | 6.34 | 1.10 | 0.26 | 6.96 | 298—2000 | |
| 151. | НNO3 (ж.) | -173.0 | 156.16 | — | — | — | 109.87 | -41.35 | 37.30 | — | — | — | 26.26 | ||
| 152. | HNO3 (г.) | -133.90 | 266.39 | — | — | — | 58.58 | -32.00 | 63.67 | — | — | — | 14.00 | ||
| 153. | HF (г.) | -268.61 | 173.51 | 27.70 | 2.93 | 29.16 | -64.2 | 41.47 | 6.62 | 0.7 | — | 6.96 | 298-2000 | ||
| 154. | HJ (г.) | 25.94 | 206.30 | 26.32 | 5.94 | 29.16 | 6.2 | 49.30 | 6.29 | 1.42 | 0.22 | 6.96 | 298—1000 | ||
| 155. | Н2O (г.) | -241.84 | 188.74 | 30.00 | 10.71 | 0.33 | 33.56 | -57.80 | 45.11 | 7.17 | 2.56 | 0.08 | 8.02 | 298—2500 | |
| 156. | Н2O (ж.) | -285.84 | 69.106 | — | — | — | 75.31 | -68.32 | 16.75 | — | — | — | 18.00 | ||
| 157. | Н2O (кр.) | -291.85 | (39.33) | -0.197 | 140.16 | — | — | -69.75 | (9.4) | -0.047 | 33.50
|