
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теорія будови атома Гідрогену Н. Бора
Враховуючи квантову теорію світла, лінійчатий характер атомних спектрів і модель атома Резерфорда, датський фізик Н.Бор у 1913 році сформулював основні положення своєї теорії будови атома Гідрогену у вигляді постулатів.
Перший постулат Бора
Електрон обертається навколо ядра не випромінюючи енергію тільки на певних колових орбітах, які називаються стаціонарними або квантованими. На основі квантової теорії Н. Бор прийняв, що момент кількості руху електрона може змінюватись стрибкоподібно відповідно рівняння:
р = m v r = (h /2p)· n.
З цього рівняння, а також використовуючи рівняння E = mv 2 = e 2/ r він визначив швидкість і енергію електрона та радіуси квантових орбіт, на яких можливий рух електронів без випромінювання:
v =  ·
· 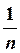 ; Е =
; Е = 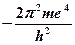 ·
· 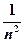 ; r =
; r = 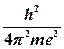 · n 2.
· n 2.
Підставляючи в ці рівняння значення h, m, e, p дістанемо r = 0,529·10–8 n 2 см = 0,529 n 2 Å, тобто радіуси квантових орбіт відносяться між собою як квадрати невеликих цілих чисел, а швидкість руху на орбітах обернено пропорційна числам натурального ряду: v 1 : v 2 : v 3 = 1/1: 1/2: 1/3....1/ n.
Другий постулат Бора
Електрон може переходити з однієї стаціонарної орбіти на другу, виділяючи або поглинаючи квант енергії. При переході на більш віддалену від ядра орбіту атом переходить у збуджений стан, енергія при цьому поглинається, оскільки потрібно подолати притягання позитивним ядром негативного електрона. При переході електрона з віддаленої орбіти на ближчу, енергія виділяється. Різниця між енергіями електрона на двох орбітах дорівнює Е = Е 2 - Е 1 = hn.
Е б = 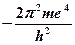 ·
· 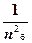 ; Е д =
; Е д = 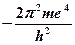 ·
· 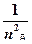 .
.
Використовуючи формулу Планка n = (E 1 – E 2)/ h, можливо розрахувати частоти випромінювань при переході с дальньої орбіти на ближчу:
n = 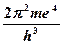 (
(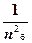 –
– 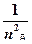 ) = 3,29·1015(
) = 3,29·1015(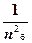 –
– 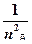 ) гц.
) гц.
На основі своєї теорії Бор розрахував спектр атома Гідрогену і ці розрахунки співпали з експериментально виявленими.
Усі можливі переходи електронів в атомі з будь-якої віддаленої орбіти на одну з близьких до ядра орбіт утворюють спектральну серію. Отже, теорія атома Бора не лише пояснила фізичну природу атомних спектрів, але й дала змогу розрахувати спектри. Проте її успіхи обмежувались тільки атомом Гідрогену, тому що вона не враховувала взаємне відштовхування електронів в багатоелектронних атомах.
Створюючи свою модель будови атома Гідрогена, Н. Бор розглядав електрон як класичну матеріальну частину. Проте на основі теорії Планка - Ейнштейна про світлові кванти було доведено, що не можна автоматично поширювати закони, справедливі для макромиру на об’єкти мікросвіту – атоми, електрони, фотони. Оскільки розміри цих частинок дуже малі порівняно з розмірами макротіл, їх властивості якісно відрізняються від властивостей останніх. Тому постала потреба в розробці нової фізичної теорії для описання властивостей і поведінки об’єктів мікросвіту.
4. Хвильова природа електрона. Електронні хмари.
У 20-тих роках ХХ сторіччя завдяки роботам де Бройля, Шредінгера, Гейзенберга та інших вчених були розроблені основи хвильової теорії про двоїсту корпускулярно - хвильову природу світлового випромінювання. З рівнянь Планка (Е = h n) і Ейнштейна (Е = mc 2) випливає, що h n = mc 2. Враховуючи, що n = с /l і швидкість руху фотона дорівнює швидкості світла, дістанемо основне рівняння хвильової механіки – рівняння де Бройля:
l = h / mv.
З цього рівняння випливає, що частинці з масою m, яка рухається зі швидкістю v, відповідає хвиля з довжиною l. Це рівняння використовується не лише для фотонів, але і для інших матеріальних частинок – електронів, протонів, тощо. Отже, електрон є одночасно і частинкою і хвилею. У 1925 році Гейзенберг запропонував принцип невизначенності, за яким не можна одночасно встановити точне місце перебування електрона у просторі та його швидкість, або імпульс.
Нове уявлення про електрон примусило відмовитись від прийнятої раніше моделі атома. Згідно з новою теорією, електрон може перебувати у будь-якій частині простору, який оточує ядро атома, однак ймовірність його перебування в тій чи іншій його частині неоднакова.
5. Рівняння Шредінгера. Квантові числа.
Рух електрона має хвильовий характер, тому квантова механіка описує цей рух за допомогою хвильової функції y (псі), яка набуває різних значень у різних точках атомного простору. Відомо, щоб знайти точку у просторі треба визначити її координати X, Y, Z, що математично записуються залежністю
y = f (X,Y,Z).
Оскільки рух електронів хвильоподібний, визначення хвильової функції зводиться до знаходження амплітуди електронної хвилі. Рух електронної хвилі можна кількісно характеризується амплітудою y, яку можна обчислити з диференціального рівняння Шредінгера, що зв’язує y з повною енергією електрона. Скорочений вигляд цього рівняння
Н y = Е y,
де Н – оператор Гамільтона, який показує порядок дій для отримання певного значення хвильової функції.
Функція y трактується також як амплітуда електронної хвилі, а величина y dV виражає ймовірність перебування електрона в обємі dV, y2 виражає ймовірнсть перебування електрона у певній точці атомного простору.
Як модель стану електрона в атомі, в квантовій механіки прийнято уявлення про електронну хмару, густина відповідних ділянок якої пропорційна ймовірності перебування там електрона. Електрони ніби розмазані навколо ядра по сфері, віддаленої від нього на певну відстань. Максимальна густина відповідає найбільшій ймовірності перебування електрона, тобто визначається величиною y2. Очевидно, чим міцніше зв’язок електрона з ядром, тим електронна хмара менше за розміром і компактніша за розподілом заряду. Простір навколо ядра, де перебування електрону найбільш ймовірно називається електронною орбіталлю.
Отже, замість боровских орбіт ядро атома оточено електронними хмарами. Основними характеристиками, які визначають рух електрона навколо ядра, є його енергія і просторові особливості відповідної йому орбіталі.
Згідно з квантово-механічною теорією стан електрона в атомі характеризується значеннями чотирьох квантових чисел: n - головного, l - орбітального, ml - магнітного і ms - спинового.
Головне квантове число (n) визначає енергію електрона та радіус квантованого рівня (середню відстань від ядра до ділянки підвищеної електронної густини), на якому цей електрон знаходиться. Воно може мати додатні цілочислові значення від одиниці до безконечністі: 1,2,3....¥. Найменшу енергію електрон має при n =1 і цей рівень зветься основним. Зі збільшенням значення n загальна енергія електрона збільшується і рівні, якi відповідають цим енергіям звуться збудженими. У основному стані електрон пов’язаний з атомом найміцніше. Для енергетичних рівнів електрона у атомі прийняті позначення латинськими літерами, але використовуються і цифри:
Головне квантове число 1 2 3 4 5 6 7
Енергетичні рівні K L M N O P Q
Максимальна кількість рівнів у атомі відповідає номеру періоду, в якому розміщений певний елемент.
Орбітальне квантове число l. Основні енергетичні рівні складаються з певного числа підрівнів. Для характеристики енергії електрона на підрівні і форми електронних орбіталей введено орбітальне квантове число. Воно відповідає значенню орбітального моменту кількості руху електрона, який обчислюється за формулою:
М = h /2p Ö l (l +1)
Воно може мати значення від 0 до (n -1). Кожному значенню l відповідає певний підрівень. Енергетичні підрівні позначаються цифрами або маленькими латинськими літерами
Орбітальне квантове число 0 1 2 3
Енергетичні підрівні s p d f
Можлива кількість підрівнів для кожного рівня дорівнює номеру цього рівня, тобто величині головного квантового числа. Так на першому рівні може бути тільки один підрівень, з l = 0, на другому – два, з l = 0 та l = 1. Третій рівень має три підрівні з l = 1, 2, 3. Відповідно до буквених позначень енергетичних підрівнів електрони, які перебувають на них називаються s-, p-, d- та f -електронами. При певному значенні головного квантового числа n найменшу енергію мають s -електрони, найбільшу – f -електрони.
Відповідно квантово-механічним розрахункам s -орбіталі мають форму кулі, р -орбіталі – форму гантелі, d - і f -орбіталі – складну форму.
Магнітне квантове число ml. З розв¢язання рівняння Шредингера витікає, що електронні хмари орієнтовані в просторі. Просторова орієнтація електронних хмар характеризується магнітним квантовим числом – ml. Воно приймає будь-яке ціле числове значення від + l до – l, включно 0. Таким чином, кількість можливих значень магнітного квантового числа дорівнює 2 l + 1. При l = 0 магнітне квантове число має тільки одне значення, ml = 0, це означає, що s -електрони мають кульову симетрію і тільки одним чином розташовані у просторі. При l = 1 магнітне квантове число має три значення: ml = 1, ml = 0 і ml = – l. Три значення магнітного числа характеризують три стани р -електронів, що відповідає орієнтації р -хмар в просторі в трьох взаємо перпендикулярних площинах по вісях координат х, у та z.
При l = 2 ml має п'ять значень: ml = 2, ml = 1, ml = 0, ml = –2, ml = –1. П’ять значень магнітного квантового числа відповідають п'яти просторовим положенням d –електронних хмар. Орбітальному квантовому числу 3 відповідає сім значень магнітного числа і сім просторових положень f -хмар.
Вивчення атомних спектрів показало, що три квантових числа n, l і ml, які введені в рівняння Шредінгера, не повністю характеризують поведінку електронів в атомі. С атомних спектрів було доведено, що електрон, рухаючись в полі ядра атома, крім орбітального моменту імпульсу має також власний момент імпульсу, що характеризує його веретеноподібне обертання навколо власної вісі. Ця властивість електрона отримала назву спіна. Розмір і орієнтацію спіна характеризує спінове квантове число тS, яке може приймати значення + 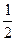 та –
та – 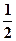 . Позитивне та негативне значення спіна пов'язані з його напрямленістю. Оскільки спін – векторна величина, його умовно позначають стрілкою, направленою вгору або вниз: і ¯. Електрони, що мають, однаковий напрям спінів називаються паралельними, протилежний напрямок – антипаралельними.
. Позитивне та негативне значення спіна пов'язані з його напрямленістю. Оскільки спін – векторна величина, його умовно позначають стрілкою, направленою вгору або вниз: і ¯. Електрони, що мають, однаковий напрям спінів називаються паралельними, протилежний напрямок – антипаралельними.
Отже, стан електрона в атомі повністю характеризується чотирма квантовими числами: n, l, ml і s.
Date: 2015-09-05; view: 311; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |