
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическое равновесие. 3.2. В соответствии с законом действия масс, начальная скорость растворения рассматриваемых тел в растворе соляной кислоты будет определяться
3.1. 0,006 моль/(л×с).
3.2. В соответствии с законом действия масс, начальная скорость растворения рассматриваемых тел в растворе соляной кислоты будет определяться, прежде всего площадью поверхности этих тел, и некоторыми вторичными, менее значимыми факторами.
В первом варианте при одинаковой площади поверхности тел (Sк= Sт = Sш) именно вторичным фактором может определяться некоторое различие скоростей растворения. Таким фактором является наличие у куба и тетраэдра ребер, на которых скорость растворения больше, чем на гладкой поверхности шара. Следовательно, здесь может иметь место, следующее соотношение скоростей растворения:
Vк» Vт > Vш
Для рассмотрения варианта Vк = Vт = Vш определим сначала зависимость площади поверхности от объема тела [Рывкин А.А., Хренов Л.С. Справочник по математике. – Изд. 5-е. – М.: Высшая школа, 1987.- 634 с].
 ;
; 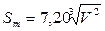 ;
; 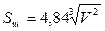 .
.
Из приведенных формул следует:
Sт > Sк > Sш и Vт > Vк > Vш.
То же соотношение скоростей будет при m к = m т = m ш, так как значение массы при постоянной плотности вещества (r) пропорционально объему (m = r V).
В последнем варианте (a к> a т > D ш) будет: Sк = 6 a2; Sт = 1,73 a2; Sш = 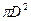 = 3,14 a2, то есть:
= 3,14 a2, то есть:
Sк > Sш > Sт и Vк > Vш > Vт
 3.3. [H2]0 = 0,40 моль/л H2+ I 2 «2 HI
3.3. [H2]0 = 0,40 моль/л H2+ I 2 «2 HI
[I 2]0= 0,30 моль/л В процессе реакции расходуется х моль
К = 40 H2 и I 2 и образуется 2х моль HI.

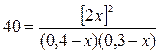 Þ х = 0,15 моль/л
Þ х = 0,15 моль/л
[H2]p-? [ I 2]p -? [H2]p = [H2]0 - х = 0,4 – 0,15 = 0,25 моль/л
[I 2]p = [ I 2]0 – х = 0,3 -0,15 = 0,15 моль/л
3.4. D t = + 50 °С; t2 » 3,7 с; t3» 61 ч» 2,5 сут.
3.5. В соответствии с принципом Ле Шателье, при понижении температуры равновесие сместится в сторону экзотермической реакции. Описанная в условии реакция (прямая) является эндотермической. Следовательно, равновесие сместится в сторону обратной (экзотермической) реакции, т.е. влево.
При любом изменении давления равновесие не нарушится, так как количество вещества исходных газообразных веществ и газообразных продуктов реакции одинаково.
3.6. Увеличить количество вещества фосфора (твердое вещество) можно лишь пропорционально увеличивая его объем и массу. При этом концентрация вещества не изменяется. Следовательно, равновесие не нарушается.
3.7.Уменьшение концентрации одного из реагентов (О2) приведет к смещению равновесия в сторону обратной реакции (влево).
3.38. ж) Высокая температура (> 400 °С); V¯ влево; p ¯ вправо; Т вправо; n(CaCO3) не смещается.
3.39. За счет увеличения давления скорость прямой реакции увеличится в 16 раз, обратной – в 4 раза.
За счет снижения температуры скорость прямой реакции уменьшится в 25 = 32 раза,, обратной 35 = 243 раза.
Суммарное изменение скорости прямой реакции составит: 
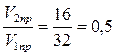 , т.е. уменьшится в 2 раза. Изменение скорости обратной реакции составит
, т.е. уменьшится в 2 раза. Изменение скорости обратной реакции составит 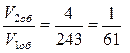 , т.е. уменьшится примерно в 61 раз.
, т.е. уменьшится примерно в 61 раз.
Таким образом, учитывая, что по условию V1 пр = V1 об, получаем, что скорость прямой реакции после повышения давления и снижения температуры станет больше скорости (V2 пр > V2 об) и поэтому равновесие сместится вправо.
Date: 2015-09-18; view: 347; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |