
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Понятие о скорости химического процесса
Скорость химической реакции определяется числом молекул, реагирующих в единицу времени в единице объема.
Так как это число эквивалентно изменению количества вещества (исходного или продукта), то можно записать:
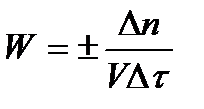
Однако, для реакции N2 + 3H2→ 2NH3 убыль водорода превышает убыль азота втрое,поэтому точнее следует говорить не о скорости химического процесса вообще, а о скорости превращения какого либо компонента или о скорости по некоторому компоненту:
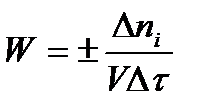
Изучение различных реакций показывает, что скорость превращения может меняться в ходе реакции, т.е.скорость является функцией времени:
W = f (τ). Поэтому вместо средней величины W применяют более точную характеристику быстроты химического превращения – истинную скорость (W ист.)

Такой подход к определению скорости справедлив как для гомогенных, так и для гетерогенных реакций. Однако быстроту гомогенных превращений удобнее характеризовать величиной:
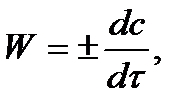
где 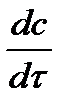 - производная концентрации по времени. Единицы измерения скорости реакции (W) в CИ 1моль/(л ∙с). В биохимической практике мг/(100мл ∙с).
- производная концентрации по времени. Единицы измерения скорости реакции (W) в CИ 1моль/(л ∙с). В биохимической практике мг/(100мл ∙с).
В химической кинетике широко используется графический метод изображения функциональных зависимостей. Кривая, отражающая изменение какого-либо вещества во времени в ходе химического превращения, называется кинетической кривой.
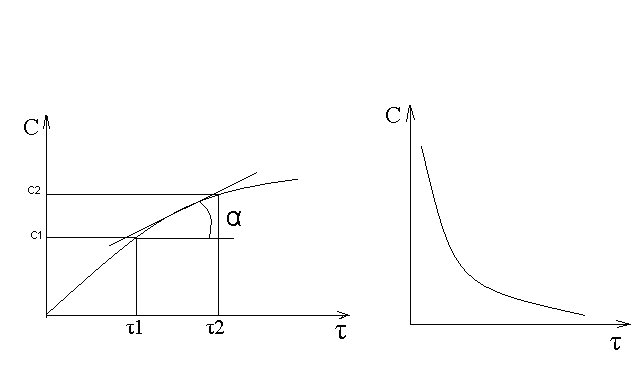
Рис.1 Кинетическая кривая для продуктов реакции. Рис.2 кинетическая кривая для реагентов
Получив кинетическую кривую для какого-либо компонента, можно легко определить скорость его накопления или расходования графическим дифференцированием кинетической кривой.
Например, среднюю скорость накопления продукта в интервале времени 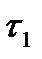 и
и 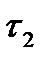 можно выразить как:
можно выразить как:
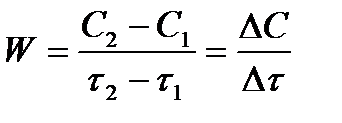
Чтобы выражение для скорости было всегда положительным при убывающей концентрации реагента, необходимо правую часть уравнения записывать с отрицательным знаком:
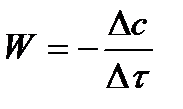
Величина скорости в каждый момент времени определяется как:
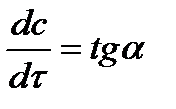
Скорость химической реакции зависит от целого ряда факторов: природы реагирующих веществ, их фазового состояния, текущих концентраций исходных и конечных веществ, температуры и др. Последовательность перечисления факторов соответствует степени их важности.
Date: 2015-09-17; view: 427; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |