
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Индивидуальные задания
1. В чем заключается сущность систематического хода анализа? Какие реактивы называются групповыми? Как пользуясь кислотно-основным методом разделить катионы Ag+ и Pb2+?
2. В чем заключается сущность дробного метода анализа? Приведите пример дробной реакции обнаружения катиона Fe3+.
3. Как и для чего проверяют полноту осаждения отделяемого катиона? К каким ошибкам кислотно-основного метода приведет неполное осаждение катионов II группы для последующего обнаружения катионов III группы в ходе анализа их смеси? Уравнения реакций напишите в вещественной и ионной формах.
4. Вычислить открываемый минимум ионов Ni2+, если предельное разбавление ионов Ni2+ в растворе равно 400000 мл/г, минимальный объем раствора, необходимый для открытия никеля капельной реакцией с диметилглиоксимом, равен 0,02 мл.
5. Почему при систематическом анализе смеси катионов кислотно-основным методом ион аммония NH4+ I группы обнаруживают в предварительной пробе? Каким образом можно удалить ионы аммония из смеси катионов (уравнения реакций)?
6. Почему при обнаружении катионов Ва2+ действием дихромата калия добавляют ацетат натрия? Напишите реакцию в молекулярной и ионной формах и объясните механизм действия буферного ацетатного раствора.
7. Используя кислотно-основной метод анализа, укажите, какие соединения и почему выпадут в осадок, а какие останутся в растворе, если на смесь катионов IV и V групп Fe2+, Mn2+, Mg2+, Cu2+, Ni2+,Co2+ подействовать избытком раствора гидроксида аммония? Напишите уравнения реакций в вещественной и ионной формах.
8. Приведите примеры использования реакций комплексообразования в кислотно-основном методе анализа. Напишите уравнения реакций.
9. Проанализировать смесь, состоящую из ионов: Cl-, Br-, J-.
10. Что называется степенью диссоциации (ионизации)? Как изменяется степень диссоциации слабых электролитов при добавлении одноименных ионов и при разбавлении растворов?
11. Чем различается диссоциация (ионизация) в водных растворах сильных и слабых электролитов? Приведите примеры схем ионизации. Что такое активность?
12. В чем заключается сущность протолитической теории Бренстеда-Лоури? Приведите примеры кислот, оснований.
13. Какие соединения являются в водном растворе кислотами, а какие основаниями с точки зрения протолитической теории Бренстеда-Лоури: Н2О, NH3, HClO4, CN-, CO32-, HCO3-, Cl-?
14. Буферные растворы обладают определенной буферной емкостью. Чем измеряется емкость буферных систем? Приведите примеры буферных систем. Объясните механизм их действия.
15. Что такое активность, коэффициент активности, ионная сила раствора? В каких случаях коэффициент активности можно принять равным единице? Рассчитайте активность сульфат-иона в растворе, полученном при смешивании 40 мл 0,4 моль/л раствора сульфата натрия и 60 мл 0,2 моль/л раствора хлорида калия.
16. Какие вещества называют электролитами и неэлектролитами? Сильные и слабые электролиты. Приведите примеры.
17. Какие электролиты называют сильными и слабыми? Что называют степенью диссоциации (ионизации)? Каково ее математическое выражение? Напишите формулы известных Вам сильных и слабых кислот и оснований. Найдите в справочнике значения констант диссоциации (ионизации).
18. Напишите математическое выражение константы диссоциации (диссоциации) уксусной кислоты. Найдите ее числовое значение в справочнике. Имеют ли сильные электролиты константы диссоциации?
19. Сформулируйте закон действующих масс. Что называют константой химического равновесия? Укажите факторы, определяющие равновесие (примеры).
20. Сколько мл воды надо прибавить к 100 мл 48%-ного раствора азотной кислоты (плотность =1,303 г/см3), чтобы получить 20% раствор.
21. Вычислите рН раствора, содержащего 1,00 г соляной кислоты в 1 л раствора.
22. Вычислите рН раствора, содержащего 1,20 г уксусной кислоты в 200,0 мл раствора. К  = 1,8·10-5.
= 1,8·10-5.
23. Вычислите рН раствора гидроксида калия, если в 200 см3 раствора содержится 1,400 г КОН.
24. Вычислите рН раствора, полученного разбавлением 10,0 мл 0,1000 N раствора аммиака до 50,00 мл. К  = 1,74·10-5.
= 1,74·10-5.
25. Вычислите рН раствора, полученного разбавлением 5,0 мл 27%-ного раствора гидроксида калия до 300,0 мл
26. Вычислите рН 0,25%-ного раствора, аммиака. К  =1,74•10-5.
=1,74•10-5.
27. Вычислите рН раствора, полученного разбавлением водой 200,0 мл 12%-ного раствора азотной кислоты до 2000,0 мл.
28. Вычислите рН раствора, полученного разбавлением водой 50,00 мл 18%-ного раствора гидроксида натрия до 250,0 мл.
29. Смешаем равные объемы растворов сильных кислот и щелочи с рН=2 и рН=11. Вычислите рН полученного раствора.
Вычислите Н+ и рН 0,0500 N раствора муравьиной кислоты. КНСООН = 1,8·10-4.
30. Вычислите рН ацетатной буферной смеси, содержащей по 0,10 молю кислоты и соли. Как изменится рН при добавлении к 1 л смеси 0,01 моля кислоты? К  = 1,8·10-5.
= 1,8·10-5.
31. Чему равен рН аммонийной буферной смеси, содержащей по 0,10 моля аммиака и соли. Как изменится рН при добавлении к 1 л смеси 0,01 моля гидроксида натрия? K  = 1,74·10-5.
= 1,74·10-5.
32. Какова буферная емкость и рН раствора, содержащего по 1 моль/дм3 уксусной кислоты и ацетата натрия? (К  = 1,8 ·10-5)
= 1,8 ·10-5)
33. Вычислите рН ацетатной буферной смеси, полученной растворением 1,64 г ацетата натрия в 100,0мл 0,20 н. раствора уксусной кислоты. К  = 1,8·10-5.
= 1,8·10-5.
34. Вычислите рН формиатной буферной смеси, полученной растворением 1,0 г гидроксида натрия в 250,0мл 0,20 н. раствора муравьиной кислоты. КНСООН = 1,8·10-4.
35. Вычислите рН ацетатной буферной смеси, полученной растворением 100,0 мл 0,40 н. раствора ацетата натрия с 100,0мл 0,20 н. раствора соленой кислоты. К  = 1,8·10-5.
= 1,8·10-5.
36. Вычислите рН раствора, полученного смешенного 19 см3 6,2 н. раствора уксусной кислоты и 1 см3 2,0 н. раствора ацетата натрия.
37. Вычислите рН аммонийной буферной смеси, полученной смешением 80 см3 0,20 н. раствора аммиака с 70,00 см3 0,20 н. раствора соляной кислоты. К (NH3+H2O) = 1,74·10-5.
38. Как изменится рН раствора при добавлении 10,00 мл. 1,0000 N раствора соляной кислоты к 1 л ацетатной буферной смеси, состоящей из 0,1000 N уксусной кислоты и 1,0000 N ацетата натрия. К  = 1,8·10-5.
= 1,8·10-5.
39. 500,0 мл раствора содержит 4,0 г аммиака и 53,0 г хлорида аммония. Вычислите концентрацию ионов Н+,  и рН раствора. К
и рН раствора. К  = 1,74·10-5, молярная масса NН3 = 17; NН4Cl = 53,5.
= 1,74·10-5, молярная масса NН3 = 17; NН4Cl = 53,5.
40. Сколько мл 5%-ного раствора ВаCl2 нужно взять для осаждения сульфат иона из 10,00 мл 1%-ного раствора серной кислоты?
41. Что такое точка эквивалентности титрования и как она фиксируется?
42. Что такое скачок титрования? Как, используя кривую титрования, правильно выбрать индикатор?
43. Как, зная константу диссоциации (ионизации) кислотно-основных индикаторов, найти интервал рН изменения окраски этих индикаторов рH?
44. Приведите кривую титрования 0,02 N раствора КОН 0,02 н. раствором HNO3. В каких приделах рН должны лежать величины рТ индикаторов, пригодных для этого? Обоснуйте выбор индикатора.
45. Приведите кривую титрования раствора аммиака раствором соляной кислоты. Укажите рН среды в точке эквивалентности. Обоснуйте выбор индикатора.
46. Приведите кривую титрования раствора муравьиной кислоты раствором гидроксида калия. Укажите рН среды в точке эквивалентности. Обоcнуйте выбор индикатора.
47. Какая реакция лежит в основе метода кислотно-основного титрования? Как меняется рН раствора при титровании слабой кислоты сильным основанием? В какой среде находится точка эквивалентности?
48. Охарактеризуйте тетраборат натрия как исходное вещество, применяемое при стандартизации кислот. Напишите уравнения химических реакций тетрабората натрия с соляной кислотой. Обоснуйте выбор индикатора.
49. Можно ли титровать 0,1 N раствора гидроксида натрия 0,1 N раствором соляной кислоты с индикатором нитрамином (рТ = 12)? Приведите кривую титрования и с ее помощью решите вопрос о возможности применения индикатора нитрамина.
50. Какую навеску КОН надо взять, чтобы на титрование ее израсходовалось 20 мл раствора НCl с титром по КОН 0,0040 мг/мл.
51. Рассчитайте нормальность, поправочный коэффициент (К) и титр по НCl раствора NаОН с титром Т = 0,004120 г/см3.
52. Для приготовления стандартного раствора карбоната натрия взяли навеску 1,3250 г х.ч. Nа2СО3, растворили ее и разбавили раствор водой в мерной колбе до объема 250,00 мл. Вычислите титр карбоната натрия по соляной кислоте.
53. Рассчитайте содержание СН3СООН в растворе в граммах, если на титрование пошло 20,00 мл гидроксида натрия с титром 0,04614 г/мл. Вычислите титр гидроксида натрия по уксусной кислоте.
54. На титрование раствора, содержащего х.ч. карбонат натрия, израсходовано 20,00 мл 0,1200 N раствора соляной кислоты. Вычислите титр НСl по карбонату натрия и содержание Nа2СО3 в граммах.
55. Рассчитайте навеску х.ч. щавелевой кислоты для приготовления 500,0 мл 0,1000 N раствора и вычислите титр полученного раствора Н2С2О4·2Н2О по КОН.
56. На титрование раствора, содержащего 1,0250 г х.ч. Н2С2О4·2Н2О требуется 25,00 мл гидроксида натрия. Вычислите титр и нормальность раствора гидроксида натрия, а также титр его по щавелевой кислоте.
57. Рассчитайте титр раствора соляной кислоты по гидроксиду натрия, если на титрование раствора, содержащего 0,2167 г х.ч. карбоната натрия требуется 21,00 мл этого раствора.
58. На титрование 20,00 мл раствора соляной кислоты с титром 0,003512 г/мл израсходовано 25,00 мл раствора гидроксида натрия. Вычислите титр NаОН по НСl и титр NаОН по Н2SО4.
59. Сколько граммов серной кислоты содержится в растворе, если на титрование этого раствора израсходовано 20,00 см3 раствора NаОН с ТNаОН/Н 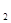 SO
SO 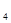 = 0,003485 г/см3?
= 0,003485 г/см3?
60. Навеску образца 0, 1535 г оксида магния растворили в 40,00 мл соляной кислоты с титром 0,003646 г/мл. На титрование избытка кислоты израсходовано 7,50 мл NаОН с титром 0,004040 г/мл. Вычислить процентное содержание MgО в образце.
61. На титрование раствора, содержащего 3,5580 г технического КОН, израсходовано 28,00 мл раствора НСl с титром по NаОН 0,07492 г/мл. Вычислите процентное содержание КОН в образце.
62. Навеску 2,2418 г технического тетрабората натрия растворили в мерной колбе емкостью 100,00 мл. На титрование 20,00 мл этого раствора израсходовано 25,50 мл соляной кислоты с титром по гидроксиду натрия 0,003974 г/мл. Вычислите процентное содержание тетрабората натрия Nа2В4О7·10 Н2О в образце.
63. Навеску сплава, равную 0,5000 г растворили в кислоте, цинк из раствора осадили гидрофосфатом натрия в присутствии аммиачного буферного раствора. Осадок отфильтровали и растворили в 100 см3 0,1 N раствора Н2SO4. Избыток кислоты оттитровали 15,00 см3 0,1000 N раствора NаОН. Определите процентное содержание цинка в сплаве.
64. Навеску 1,0606 г х.ч. карбоната натрия растворили в мерной колбе объемом 100,0 мл. На титрование 20,00 мл этого раствора в присутствии индикатора метилового оранжевого израсходовано 25,75 мл раствора НСl. Вычислите нормальность и титр раствора НСl.
65. Навеску 0,6000 г х.ч. Н2С2О4·2Н2О растворили в мерной колбе объемом 100,0 мл. На титрование 10,00 мл этого раствора израсходовано 9,52 мл NаОН. Вычислите нормальность раствора NаОН и его титр по щавелевой кислоте.
66. Навеску 0,3950 г известняка растворили в 50,00 мл 0,1295 N раствора НСl. На титрование избытка кислоты израсходовано 10,55 мл раствора NаОН с титром 0,004465 г/мл. Вычислите процентное содержание СаСО3 в образце.
67. Навеска образца оксида цинка 0,2046 г растворена в 50,00 мл раствора серной кислоты с титром 0,004904 г/мл. Избыток кислоты оттитрован 10,00 мл раствора NаОН с титром 0,004040 г/мл. Вычислите процентное содержание ZnO в образце.
68. Навеску 2,6835 г соды растворили в мерной колбе объемом 250,00 мл. На титрование 25,00 мл этого раствора израсходовано 20,55 мл раствора НСl с титром по Nа2СО3 0,005300 г/мл. Вычислите процентное содержание Nа2СО3 в образце.
69. Навеску 0,5000 г карбоната кальция растворили в 25,00 мл 0, 5100 N раствора соляной кислоты. Избыток кислоты был оттитрован 6,50 мл 0,4900 N раствора NаОН. Вычислите процентное содержание карбоната кальция СаСО3 в образце.
70. Какова должна быть навеска руды, содержащей 52,30 % железа, чтобы после растворения её и восстановления Fе3+ до Fе2+ на титрование расходовалось 25 см3 0,1000 N раствора перманганата калия?
71. На титрование 0,1136 г х.ч. Na2С2О4 в кислой среде израсходовано 20,75 мл КМnО4. Определите нормальность раствора КМnО4 и его титр по железу (II).
72. В мерной колбе емкостью 250,0 мл растворена навеска 1,4425 г технического нитрита натрия. На титрование 20,00 мл этого раствора израсходовано 25,00 мл раствора КМnО4.с титром 0,001520 г/мл. Определите процентное содержание NaNO2 в образце.
73. К образцу пиролюзита массой 0,32 17 г, растворенного в серной кислоте, было прибавлено 0,4130 г кристалической х.ч. щавелевой кислоты. На титрование избытка щавелевой кислоты израсходовано 15,00 мл 0,1000 N раствора КМnО4. Определите процентное содержание МnО2 в образце пиролюзита.
74. К раствору КСlО3 прибавили 50,00 мл 0,1048 N раствора FeSO4, избыток которого оттитровали 20,00 мл 0,0945 N раствора КМnО4. Сколько г КСlО3 содержится в растворе?
75. К раствору, содержащему 0,1510 г технического КСlО3, прилили 100,00 мл 0,0985 N раствора Na2С2О4, избыток которого оттитровали 48,60 мл 0,0532 N раствора КМnО4. Вычислите процентное содержание КСlО3 в образце.
76.Навеска 0,7840 г сульфита натрия растворена в мерной колбе емкостью 250,0 мл. К 25,00 мл этого раствора прибавлено 50,0 мл 0,0450 N раствора йода, избыток которого оттитрован 25,0 мл 0,0500 N раствора тиосульфата натрия. Сколько процентов Na2SО3 содержит образец?
77. Навеску 2,5 г технического хлорида натрия растворили в 500 мл воды. На титрование 10 мл полученного раствора затратили 16,85 мл 0,0005 N раствора нитрата серебра. Каково процентное содержание хлорида натрия в образце?
78. Определите процентное содержание сульфида натрия в образце. Навеску 0,2500 г образца растворили в воде в мерной колбе на 500 см3. К 20,00 см3 этого раствора прибавили 50 см3 0,0500 N раствора иода, избыток которого оттитровали 15 см3 0,0500 N раствора тиосульфата натрия.
79. Из 1,4500 г технического Na2SО3 приготовили 200,0 мл раствора. На титрование 20,00 мл его израсходовано 16,20 мл 0,0124 N раствора йода. Определите процентное содержание Na2SО3 в образце?
80. Из 0,5100 г руды медь после ряда операций была переведена в раствор в виде соли меди (II). При добавлении к этому раствору избытка иодида калия выделился йод, на титрование которого пошло 14,10 мл тиосульфата натрия Na2S2O3·5H2O с титром по меди 0,006500 г/мл. Сколько процентов меди содержит руда?
81. На титрование йода, выделившегося из иодида при действии 12,50 мл раствора КМnО4, титр которого равен 0,001544 г/мл, израсходовано 17,05 мл раствора тиосульфата натрия. Вычислить титр раствора тиосульфата и его нормальность.
Какую навеску дихромата калия нужно взять для стандартизации 0,1 N раствора тиосульфата натрия, если навеску растворить в мерной колбе 200 см3, воспользоваться пипеткой, емкостью 10 см3 и чтобы на титрование, после добавления избытка иодида калия, расходовалось 25 см3 раствора тиосульфата натрия.
82. Для определения Н2S к 20 см3 раствора прибавили 50 см3 0,01880 N раствора иода. На титрование избытка иода затрачено 10,00 мл 0,0194 N раствора тиосульфата натрия. Сколько граммов Н2S содержится в 1 дм3 исследуемого раствора?
83. Навеска 0,2000 г руды, содержащей МnО2, была обработана избытком концентрированной соляной кислоты. Образовавшийся при реакции хлор был отогнан и поглощен раствором иодида калия. На титрование выделившегося при этом йода пошло 42,50 мл 0,0520 N раствора тиосульфата натрия. Сколько процентов МnО2, содержит руда?
84. К 25,00 мл раствора дихромата калия прибавлен избыток иодида калия и серная кислота; на титрование выделившегося йода израсходовано 30,00 мл 0,1000 N раствора тиосульфата натрия. Сколько граммов К2Сr2О7 содержит один литр раствора?
85. На титрование йода, выделившегося при обработке навески PbO2 иодидом калия в кислой среде, израсходовано 25,00 мл раствора тиосульфата натрия с титром 0,02480 г/мл. Сколько граммов PbO2 содержится в навеске?
86. В мерной колбе емкостью 250 мл растворили 0,7112 г х.ч. оксалата аммония (NH4)2C2O4·2Н2О. Какой объем перманганата калия, титр которого 0,001420 г/мл, пойдет на титрование 25,00 мл полученного раствора оксалата аммония? (Среда кислая).
87. Сколько процентов железа содержит руда, если на титрование раствора, полученного при растворении навески руды 0,2500 г в соляной кислоте, израсходовано 28,00 мл 0,09950 н. раствора КМnО4?
88. Какую среду раствора и почему создают при комплексонометрических определениях ионов Са2+ и Мg2+? Приведите уравнения химических реакций; укажите, как обеспечивают нужный рН раствора?
89. Какие требования предъявляются к реакциям осаждения, используемых в титриметрическом анализе? Какие методы осаждения Вам известны?
90.На какой реакции осаждения основано определение хлоридов по методу Мора? Укажите рН среды, титрант и индикатор, приведите уравнения химических реакций.
91. На какой реакции комплексонометрического метода анализа основано определение жесткости воды? В каких единицах она выражается? Напишите уравнения реакции комплексона III с ионами Са2+.
92. В чем сущность роданометрического определения содержания хлора? Укажите титрант, индикатор и рН среды. Напишите уравнения реакций. Каковы преимущества этого метода по сравнению с методом Мора?
93. Индикаторы, используемые в комплексонометрии. На чем основано их действие?
94. 5 г раствора НСl разбавили водой в мерной колбе, емкостью 250 см3. К 10,00 см3 этого раствора прибавили 25,00 см3 0,1000 N раствора AgNO3. на титрование избытка израсходовано 10,00 мл 0,0500 N раствора NH4SCN. Определите процентное содержание НСl.
95. Что такое "комплексоны"? Какие функциональные группы молекул комплексонов определяют их кислотные свойства и способность образовывать комплексы?
96. На чем основано действие абсорбционных индикаторов? Приведите примеры.
97. Определите жесткость воды, если к 50 см3 воды добавлено 25,00 см3 0,0500 N раствора комплексона III и на титрование избытка его израсходовано 20,00 см3 0,0500 N раствора сульфата магния.
98. Сколько граммов металлического цинка следует растворить в 100,0 мл серной кислоты, чтобы на титрование 20,00 мл раствора расходовалось 20,00 мл 0,4000 N раствора комплексона III?
99. Навеску иодида калия растворим в воде и на титрование полученного раствора в присутствии индикатора эозина, было израсходовано 17,00мл раствора нитрата серебра с молярной концентрацией 0,0500 моль/л. Рассчитайте массу навески иодида калия.
100. Определите процентное содержание в сплаве, если после растворения навески 0,3000 г его в азотной кислоте на титрование полученного раствора израсходовано 23,80 мл 0,1000 н. раствора NH4SCN?
101. Найти среднюю квадратичную погрешность отдельного определения (S), среднюю квадратичную погрешность среднего арифметического (Sх) и относительную среднюю квадратичную погрешность среднего арифметического (Sхr) в %, а также доверительный интервал при доверительной вероятности P=0,95 для ряда полярографических определений содержания кадмия: 0,71; 0,72; 0,73; 0,74%.
102. При определении сахарозы поляриметрическим методом получены следующие результаты: 36,62; 36,81; 36,53; 36,66%. Определить доверительный интервал и представить окончательный результат анализа.
103. Провести полную статистическую математическую обработку результатов фотометрического определения бериллия в стандартном образце (по паспорту хо =2,12%); при котором были получены следующие данные (n=13); (2,05)3; 2,09; (2,12)3; 2,16; (2,18)3; 2,19; 2,25%. (индекс внизу – число опытов, давших такой результат).
104. Три повторных анализа образца хлорида дали среднее значение содержания хлорида 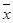 =72,10% и стандартное отклонение S=0,40%. Определить границы доверительного интервала, в которых могут находиться результаты отдельного определения при доверительной вероятности Р=0,95. (Указание: применить критерий Стьюдента для малых выборок).
=72,10% и стандартное отклонение S=0,40%. Определить границы доверительного интервала, в которых могут находиться результаты отдельного определения при доверительной вероятности Р=0,95. (Указание: применить критерий Стьюдента для малых выборок).
105. При определении хлоридов в питьевой воде нефелонометрическим методом получены следующие результаты (мг/дм3): 0,30; 0,32; 0,33; 0,34; 0,38. Является ли результат 0,38 промахом и следует ли его учитывать при статистической обработке экспериментальных данных?
106. При титровании 5 порций по 10 мл одного и того же раствора израсходованы следующие объемы кислоты (в мл): 2,35; 2,66; 2,83; 2,65; 2,96. Определите (промахи) с помощью Q-теста.
107. Какого рода ошибки опыта Вам известны? Чем обусловлены и как устраняются ошибки различного рода?
108. По данным спектрального анализа пробы при 4 параллельных определениях найдено среднее содержание примесей W=0.36%. Среднее квадратическое отклонение равно при этом 0,018%. Найти доверительный интервал результата при доверительной вероятности Р=0,95. (Указание: применить критерий Стьюдента для малых выборок).
109. Как определить правильность и воспроизводимость химического анализа? Приведите примеры.
110. Принятое значение содержания хлорида в стандартном образце 36,64%. Анализ в производственной лаборатории дал среднее значение 36,91% и стандартное отклонение 0,03% из трех определений. Определить, имеется ли систематическая ошибка в использованном методе анализа. (Указание: применить критерий Стьюдента при Р=0,95).
111. Вычислить мольную рефракцию хлорбензола при T=298 К, если показатель преломления n= 1,5243, а плотность d= 1,118·103 кг/м3.
Сравнить значение мольной рефракции с рассчитанной по правилу аддитивности.
112. Вычислить мольную рефракцию четыреххлористого углерода, если показатель преломления n20D=1.4603 г/см3. Сравните найденную рефракцию с вычисленной по таблицам атомных рефракций, и связей (d=1,6040 г/см3).
113. Вычислить мольную рефракцию уксусной кислоты, если показатель преломления n20D=1.3690, а плотность 1.2493 г/см3. Сравните найденную рефракцию с вычисленной по таблицам атомных рефракций.
114.В чем заключается аддитивность атомной и мольной рефракции?
115. Сущность рефрактометрического метода анализа.
116. Для определения состава водных растворов пропанола были определены показатели преломления стандартных растворов, приведенные ниже:
Содержание пропанола, % 0 10 20 30 40
Показатель преломления 1,3330 1,3431 1,3523 1,3591 1,3672
Построить градуировочный график и определить содержание пропанола в растворах, показатели преломления которых: а) 1,3480; б) 1,3645.
117.Вычислить мольную рефракцию бромоформа CHBr3.
118. Вычислить мольную рефракцию бензола C6H6, молекула которого состоит из 6 атомов углерода и 6 атомов водорода: а) по правилу аддитивности; б) по опытным данным: n20D=1,5204. d=0,869 г/см3.
119. Углеводород С10Н16 2,5,8-декатриен имеет показатель преломления 1,4638 и плотность, d=0,8495 г/см3. Сравнить полученную мольную рефракцию с рассчитанной по формуле этого соединения.
120. Приведите график зависимости показателя преломления от концентрации раствора и поясните его.
121. Навеску 0,6383 г сплава, содержащего медь, после растворения обработали аммиаком и получили 1000 мл окрашенного раствора, оптическая плотность которого при толщине слоя кюветы 1см равна 0.255. Молярный коэффициент погашения равен 423. Определить процентное содержание меди в сплаве.
122. Вычислить молярный коэффициент поглощения раствора меди, если оптическая плотность раствора, содержащего 0.830 г меди в 200мл при толщине слоя кюветы 5см равна 0.15.
123. Для определения меди в цветном сплаве из навески 2.000 г после растворения обработки аммиаком было получено 500мл окрашенного раствора, оптическая плотность которого в кювете толщиной 10см была 0.167. Определить процентное содержание меди в сплаве,если молярный коэффициент погашения равен 423.
124. Оптическая плотность раствора, содержащего 0.420 мг меди в 200мл при толщине слоя кюветы 1см равна 0.15. Вычислите молярный коэффициент поглощения меди.
125. Навеску 0.8000 г сплава, содержащего медь, после растворения обработали и получили 1000 мл окрашенного раствора, оптическая плотность которого при толщине слоя 2 см равна 0.24. Молярный коэффициент погашения равен 423. Определить процентное содержание меди в сплаве.
126. Молярный коэффициент погашения комплекса бериллия с ацетилацетоном в хлороформе равен 31.500. Определить процентное содержание бериллия в сплаве, если его навеска была растворена в 500мл. Оптическая плотность раствора (после соответствующей обработки) при толщине слоя кюветы 5см равна 0.54.
127. При фотометрическом определение титана с хромотроповой кислотой в растворе, содержащем 11.496 мкг титана в 10мл, кювете толщиной слоя в 2см, была получена оптическая плотность, равная 0.23. Определить молярный коэффициент погашения окрашенного соединения.
128. Молярный коэффициент погашения комплекса бериллия с ацетилацетоном в хлороформе равен 31.600. Определить процентное содержание бериллия в навеске 2.9500г растворённом в 250мл, если оптическая плотность раствора в кювете 1см равна 0.24.
129.Определить молярный коэффициент погашения окрашенного соединения полученного при фотометрическом определение титана с хромотроповой кислотой, если оптическая плотность раствора, содержащего 125мкг титана в 250 мл при толщине слоя кюветы 10см равна 0.60.
130. Определить молярный коэффициент погашения окрашенного соединения полученного при фотометрическом определение железа (111) с сульфосалициловой кислотой, если оптическая плотность раствора, содержащего в 200мл 250 мкг железа, равнялась 0.224 при толщине слоя кюветы 1 см.
131. Вычислить значение потенциала цинкового электрода, погруженного в раствор соли ZnSO4 полученный путём растворения 1.5950 г этой соли в дистиллированной воде, в мерной колбе ёмкостью 100мл, при температуре 300С.
132. Чему будет равен потенциал платинового электрода, погруженного в раствор H2SO4, содержащий в 500 мл 0.1580 г KMnO4 и 15.1000 г MnSO4 при 200С.
133. Определить концентрацию ионов меди в растворе, если известно, что при 300С значения потенциала медного электрода, погруженного в раствор CuSO4 составляет 0.2 В.
134. Рассчитать рН раствора уксусной кислоты по следующим данным: индикаторный электрод – водородный; электрод сравнения- каломельный (0.1000 N). Температура 300С, ЭДС = 0.502 В.
135. Рассчитать рН раствора уксусной кислоты по следующим данным: индикаторный электрод – хингидронный; электрод сравнения - хлорсеребряный. Температура 200С, ЭДС = 0.004 В.
136. Потенциометрическое определение активной и общей кислотности в растворе. Система электродов. Приборы.
137. Вычислить потенциал при титрование 0.0100 N раствора НСООН 0.1000 N раствором КОН в точке эквивалентности. Индикаторный электрод- хингидронный; электрод сравнения- насыщенный каломельный электрод, температура 30о С.
138. Вычислить значение потенциала кадмиевого электрода в 0,01 М растворе его соли СdSO4 при 300С.
139. Построить кривую титрования при 200С 100 мл 0,1000 N раствора CH3COOH 1,000 N раствором KOH и определить объем титранта в точке эквивалентности. Индикаторный электрод-хингидронный; электрод сравнения-хлорсеребряный (1N). Расчетные точки: 0; 50; 90; 99; 99,9; 100; 100,1; 101; 110% от точки эквивалентности.
140. Вычислить молярную концентрацию соли ZnSO4 при температуре 200С, если потенциал цинкового электрода, помещенного в раствор ZnSO4, составляет – 1,490 В. (Е0Zn2+ / Zn = -1.44 В)
141. Определите удельную и эквивалентную электропроводимость 1 М раствора хлорида калия в ячейке с 2 электродами площадью 2,0 см2 и расстоянием между ними 15 мм, если сопротивление раствора составляет 50 Ом.
142. Определить удельное сопротивление, удельную и эквивалентную электропроводимость 0,01 М раствора нитрата натрия в ячейке с электродами площадью 1,6 см2 и расстоянием между ними 8 мм, если сопротивление раствора составляет 30 Ом.
143. Вычислите удельную и эквивалентную электропроводимость 0,02 М раствора нитрата серебра, если к ячейке с круглыми электродами диаметром 1,6 см и расстоянием между ними 10 мм приложено напряжение 0,8В при силе тока 5 мА.
144. Определите сопротивление 0,1 М раствора NaNO3 в ячейке с квадратными электродами площадью 1 см2 и расстоянием между ними 5 мм, если эквивалентная электропроводимость раствора равна 100 см2/Ом∙экв.
145. Вычислите сопротивление 0,1 М раствора соляной кислоты в ячейке с электродами площадью 6,25 см2 и расстоянием между ними 20мм, если удельная электропроводимость раствора равна 0,4 Ом-1∙см-1.
146. Вычислить силу тока в ячейке, содержащей 0,1 н раствор хлорида калия с электродами площадью 4 см2 и расстоянием между ними 0,5 см, если прилагаемое напряжение составляет 400 мВ, а удельная электропроводность 1,167 Ом-1∙см-1.
147. Определите силу тока в ячейке, содержащей 0,1 N раствор нитрата натрия, с электродами площадью 2,0 см2 и расстояние между ними 10 мм, если прилагаемое напряжение равно 6,25 В и эквивалентная электропроводимость 200 см2/Ом∙экв.
148. При титровании 50,00 мл соляной кислоты 1,0000 N раствором гидроксида калия получены следующие результаты:
Объем 1,0000 N раствора KOH, V, мл 3,2 6,0 9,2 15,6 20,0 23,5
Удельная электропроводимость, æ, Ом-1∙см-1 3,20 2,50 1,85 1,65 2,35 2,95
Постройте градуировочный график и вычислите нормальность HCl.
149. При титровании 100,00 мл серной кислоты 2,0000 N раствором гидроксида натрия получены следующие результаты:
Объем 2N раствора NaOH,
V, мл 2,5 7,5 10,5 17,5 22,5 27,5
Удельная электропро- 4,50 3,15 2,10 2,12 3,45 4,60
водимость, Ом-1∙см-1
Постройте градуировочный график и вычислите нормальность серной кислоты.
150. При титровании 50,00 мл раствора уксусной кислоты 0,5000 N раствором гидроксида натрия получены следующие результаты:
Объем 0,5000 N раствора
NaOH,V, мл 8 9 10 11 13 15 17
Сопротивление R, Ом 75,0 67,8 62,3 57,0 52,9 52,3 52,1
Электропроводимость W,Ом-1
Рассчитайте электропроводимость раствора CH3COOH, постройте градуировочного график и вычислите нормальность раствора уксусной кислоты.
Date: 2015-09-17; view: 767; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |