
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Давление пара: новая зависимость давления от температуры
Уравнение, более точно, чем известные, описывающее зависимость упругости паров от температуры, выведено на основе использования параметров межмолекулярного взаимодействия в виде энергии системы, отклоненной от равновесия сил притяжения и отталкивания, и собственной энергии молекул.
Парогазовые потоки, являющиеся важнейшей составляющей большинства химических производств1, образуются в результате перехода вещества из жидкого состояния в газообразное. При этом ключевым показателем, отражающим специфические особенности вещества и потому используемым для различных расчетов в физической химии и химической технологии, а также для характеристики органических соединений, является упругость пара j-того вещества [1–17].
Упругостью пара называют давление, при котором пар находится в состоянии равновесия с жидкой (или твердой [18]) фазой при данной температуре. Поэтому вместо упругости пара часто говорят о давлении пара в состоянии насыщения Pjн при температуре Т.
Экспериментально определяемые упругости пара лежат всегда в определенном интервале и всегда дискретны, из-за чего необходимо иметь уравнение, дающее непрерывное описание зависимости упругости пара от температуры во всем интервале Pjн - Т.
Теоретически в основу такого уравнения можно положить выражение, полученное Клаузиусом и Клапейроном:
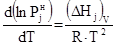 . (1)
. (1)
Интегрируя (1) в предположении, что пар обладает свойствами идеального газа, а теплота испарения (DHj)V в исследуемом интервале не зависит от температуры, получаем
–––––––––––
1 Здесь имеются ввиду любые производства, продукты которых образуются за счет химических и физико-химических превращений (например, коксохимическое, доменное и др. производства).
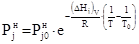 , (2)
, (2)
где Т³Т0, так что при Т=Т0 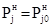 , а при Т>Т0
, а при Т>Т0  .
.
Практика, однако, показывает, что уравнение (2) дает ощутимые отклонения от эксперимента из-за невыполнения предположений об идеальности свойств насыщенного пара и независимости теплоты испарения от температуры.
Поэтому было предложено множество уравнений для описания зависимости упругости пара от температуры, различающиеся структурой, но требующих оценки параметров (коэффициентов) для каждого вещества. К предложениям, уточняющим уравнение (2) путем введения эмпирических коэффициентов, следует отнести предложения
– Антуана
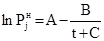 , (3)
, (3)
(в оригинале [19,20] для паров воды 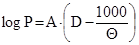 , где Q=230+t);
, где Q=230+t);
– Гутмана и Симмоса [7]
 (4)
(4)
(метод расчета величины Q рассмотрен Дройсбахом [7]).
Абсолютное большинство других предложений сводится к описанию упругости пара полиномами различной степени от температуры [7].
Согласно [7] из всех уравнений, предложенных для расчета упругости пара по величине температуры, уравнение Антуана оказалось наиболее полезным. Тем не менее, в теоретическом и практическом анализе химико-технологических задач уравнение Антуана приходится уточнять введением дополнительных параметров или сужением области исследования по группам веществ и интервалам Pjн–Т [2,3,8].
Поэтому в настоящей работе сделана попытка установить зависимость упругости паров от температуры, исходя из иных соображений и, в частности, на основе параметров потенциалов межмолекулярного взаимодействия в виде энергии системы, отклоненной от равновесия сил межмолекулярного притяжения и отталкивания, и собственной энергии молекул.
Будем исходить из того, что переход вещества из твердого состояния в жидкое обусловлен нарушением равновесия межмолекулярных сил притяжения и отталкивания. При этом колебательное движение молекул заменяется поступательным прямолинейным, так что с ростом собственной энергии молекулы у нее появляется возможность “вырваться” из жидкой фазы в газовую.
Оценим энергию межмолекулярного взаимодействия в состоянии, отклоненном от равенства разнонаправленных сил, отношением потенциальной энергии (теплоты) неравновесной системы, состоящей из N моль, к теплоемкости j -того вещества:
 . (5)
. (5)
Измеряя Qj в кДж, удельную теплоемкость CPj в кДж/(кмольqград) и Nj в кмоль, находим, что
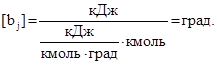
Отсюда следует, что bj оценивает энергию межмолекулярного взаимодействия числом градусов, на которое могла бы повыситься температура системы, если бы ее потенциальная энергия межмолекулярного взаимодействия перешла в кинетическую.
Таким образом, bj оценивает в градусах энергетический барьер, который должна преодолеть молекула, чтобы превысить силы межмолекулярного притяжения и “вырваться” из жидкой фазы в газообразную.
Теперь положим, что по величине собственной энергии молекулы вещества распределены симметрично (например, нормально) относительно некоторого среднего значения mj c дисперсией 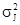 . Очевидно, что с ростом температуры за счет вешнего или внутреннего источника теплоты1 растет собственная энергия молекул, так что
. Очевидно, что с ростом температуры за счет вешнего или внутреннего источника теплоты1 растет собственная энергия молекул, так что
 , град., (6)
, град., (6)
где cj – безразмерный коэффициент; tu – температура в системе, град; u=(1,2,…,n).
Ясно, что с ростом температуры согласно (6) средняя собственная энергия молекул mj приближается к энергетическому барьеру bj, увеличивая число молекул j-того вещества, способных перейти из жидкой в газообразную фазу и, тем самым, увеличить скорость прямого процесса2 (см. рис. 1).
–––––––––––
1Источник внешний – внешняя среда, внутренний – химические реакции и физико-химические превращения, протекающие в системе.
2Прямым процессом считаем испарение, а обратным – конденсацию вещества.

Рис. 1. К соотношению bj и mj при температурах tu и tu+1
Е – энергия; j (N) – плотность распределения молекул по величине собственной энергии; – площадь под кривой плотности – общее число N молекул; – площадь заштрихованных участков
сдвигается:
–при увеличении температуры до tu+1 в сторону газовой фазы, так что 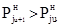 ;
;
–при снижении температуры до tu–1 в сторону жидкой фазы, так что 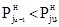 .
.
В последнем случае часть парообразного j-того вещества переходит в жидкое состояние (конденс– числа молекул, совершивших переход из жидкой фазы в газовую (Su<<Su+1).
Скорость обратного процесса определяется достигнутым содержанием j‑того вещества в газовой фазе, которое принято оценивать фактическим парциальным давлением Pj.
При постоянной температуре tu (u=1,2,…,n), достаточном количестве жидкости и достаточном времени контакта фаз Pj растет и, как следствие, растет скорость обратного процесса. Когда она становится равной скорости прямого процесса, наступает равновесие между жидким и газообразным состояниями j-того вещества, которому соответствует равновесное парциальное давление Pju*. Это давление называют парциальным давлением j-того вещества в состоянии насыщения или упругостью паров j-того вещества и обозначают Pjuн
С изменением температуры равновесие ируется).
Таким образом, следует считать, что:
1. Парциальное давление насыщенного пара, как предельно возможное при данной температуре содержание j-того вещества в газовой фазе, отражает степень неравновесности межмолекулярных сил притяжения и отталкивания в жидкости, которая сама зависит от размера, состава, строения и свойств молекул вещества.
2. Соотношение сил межмолекулярного взаимодействия и собственной энергии молекул определяет зависимость 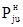 от температуры и независимость от содержания в газовой фазе других веществ.
от температуры и независимость от содержания в газовой фазе других веществ.
3. При ограниченном времени контакта фаз, что характерно для промышленных потоков и эквивалентно недостатку жидкой фазы, равновесие между жидким и газообразным состояниями не достигается и пар оказывается ненасыщенным с парциальным давлением Pju.
4. Связь между парциальными давлениями насыщенного и ненасыщенного паров описывают выражением
 , (7)
, (7)
где jj – степень насыщенности пара j-того вещества.
Поскольку из (7) следует, что
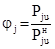 , (8)
, (8)
т.е. является отношением фактического содержания j-того вещества в газовой фазе к предельно возможному при данной температуре, jj можно назвать относительным выходом j-того вещества из жидкости в газовую фазу.
Из сформулированных выше положений, касающихся механизма парообразования, следует, что приращение равновесного парциального давления j‑того вещества в интервале температур от tu до tu+1 пропорционально уже достигнутому давлению при tu:
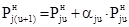 . (9)
. (9)
Из (9) для относительного приращения равновесного давления получаем:
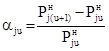 , (10)
, (10)
так что относительное приращение равновесного давления во всем температурном диапазоне t1¸tn составит
 . (11)
. (11)
Чтобы установить температурную зависимость равновесного парциального давления j-того вещества, представим его относительное приращение aju как отношение энергетического барьера bj, создаваемого силами межмолекулярного взаимодействия в жидкости, к квадрату отклонения1 от него средней собственной энергии молекул mj, приходящегося на единицу температуры в интервале от tu до tu+1:
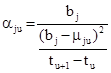
или, с учетом (6):
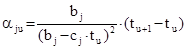 . (12)
. (12)
Теперь, подставляя (12) в левую часть (11), получаем выражение
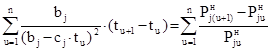 . (13)
. (13)
Сохраняя величину температурного диапазона (tn–t1) и увеличивая n (полагая n®¥), получаем, что
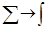 , а
, а 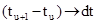 и
и  .
.
С учетом этого перехода уравнение (13) принимает вид:
 . (14)
. (14)
Принимаем, что u=bj-cjqt, так что du=-cjqdt.
С учетом этого интегрируем левую часть (14):
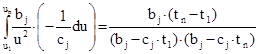 . (15)
. (15)
Теперь интегрируем правую часть (14):
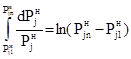 . (16)
. (16)
–––––––
1В соответствии с принципом максимального правдоподобия [21 (см. стр. 178-183), 22 (см. Гл. 18 “Оценивание: метод максимального правдоподобия”, стр. 58-126)] использование квадрата отклонения приводит к состоятельным, эффективным и несмещенным оценкам параметров статистической совокупности (в данном случае, совокупности молекул j-того вещества).
Подставляя (15) и (16) в(14), находим
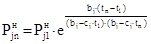 . (17)
. (17)
Из (17) следует, что при условии tn=t1 получаем 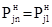 , т.е. упругость паров без увеличения температуры сохраняет уже достигнутый уровень, что полностью соответствует исходному выражению (9). Поэтому, если взять t1=00C, то уравнение (17) принимает вид:
, т.е. упругость паров без увеличения температуры сохраняет уже достигнутый уровень, что полностью соответствует исходному выражению (9). Поэтому, если взять t1=00C, то уравнение (17) принимает вид:
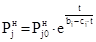 , (18)
, (18)
где Pj0н – упругость паров j-того вещества, достигнутая при подъеме температуры до 00С.
Из (18) видно, что температурная зависимость парциального давления насыщенного пара j-того вещества, полученная теоретически, является экспоненциальной функцией 3-х параметров, величины которых зависят от давления при температуре 00С, сил межмолекулярного взаимодействия в жидкости и собственной энергии молекул.
Для оценки этих параметров использовали экспериментальные данные по Pjuн и tu, взятые из [23]1 (табл. 1)2.
Значения Pj0н=aj, bj и cj находили по алгоритму и программе, минимизирующим среднее квадратическое отклонение рассчитанных по (18) величин  при tu от экспериментальных
при tu от экспериментальных 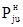 :
:
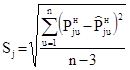 . (19)
. (19)
Область поиска задавали в виде:
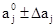 ; (20)
; (20)
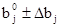 ; (21)
; (21)
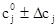 . (22)
. (22)
––––––––
1Всего в [23] приведены данные по 296-ти неорганическим и 1202-м органическим соединениям.
2Для составления табл. 1 отбирали данные по веществам, производимым на коксохимических производствах [9].
Приближенное значение aj0 берем из экспериментальных данных, учитыая, что при t=0 по (18) получаем  .
.
Например, согласно табл.1 для бензола линейное приближение зависимости PБн=fБн(t) в интервале 2,6£t£7,6 дает aБ0=3,35 кПа.
Размер области начального поиска определяли величиной 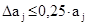 . Для примера с бензолом она составит 3,350±0,8375 кПа.
. Для примера с бензолом она составит 3,350±0,8375 кПа.
Чтобы задать начальные значения bj0 и cj0, уравнение (18) представим в виде
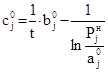 . (23)
. (23)
Запишем уравнение (23) для u-той и (u+1)-той пар значений (t, Pjн):
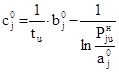 ; (24)
; (24)
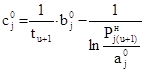 . (25)
. (25)
Вычитая (25) из(24), находим
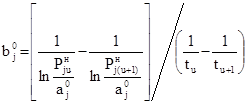 . (26)
. (26)
Подставляя (26) в (24), получаем
 . (27)
. (27)
Те же значения сj0 получим, если (26) подставим в (25).
Алгоритм и программа поиска параметров уравнения(18), реализованные для веществ, представленных в табл.1, привели к значениям параметров aj, bj и cj, обеспечивающим минимальные значения остаточного среднего квадратического отклонения SB (табл. 2).
Для сравнения в этой же таблице приведены оценки SA, характеризующие точность результатов, найденных по уравнению Антуана с использованием значений его коэффициентов, найденных методом наименьших квадратов [21].
По значениям отношения SA/SB видно, что уравнение (18) для всех веществ, приведенных в табл. 1, превосходит по точности уравнение Антуана.
Для подтверждения того, что этот вывод имеет общий характер, дополнительно исследовали экспериментальные данные по упругости паров воды и аммиака (табл. 3) в области температур, расширяющей диапазон парциальных давлений до более 6 МПа.
Результаты расчетов по уравнению (18) и уравнению Антуана представлены в табл. 4.
Таким образом по совокупности полученных результатов можно сделать вывод о высокой точности уравнения, полученного для описания зависимости упругости паров широкого спектра веществ от температуры.
Более того, исходные положения, на которых основан вывод этого уравнения, позволяют предположить, что различия его параметров для разных веществ определяются различными характеристиками вещества (например, температурой кипения*) и свойствами молекул, такими как размер (масса) и форма (циклическая, треугольная, пирамидальная, с разветвленной углеродной цепью, с линейной цепью), сферичность, полярность, дипольный момент. Существенное влияние могут оказывать и надмолекулярное структурирование вещества и, в частности, ассоциированный (вода, метанол, этанол, фенолы, ацетон) и неассоциированный (азот, бензол, гексан, сероуглерод, четыреххлористый углерод) характер.
Предварительная проверка этих соображений на примере параметра bj проведена по данным из табл. 2 и 4 (рис. 2).

Рис. 2. Зависимость параметра bj от молекулярной массы j-того вещества
––––––
*Чем ниже температура кипения, тем больше aj.
Видно, что значение потенциала сил межмолекулярного взаимодействия зависит прежде всего от размера молекулы: практически все точки группируются около прямых I, II и III.
При этом 75% точек, располагающихся вдоль прямой II, соответствуют парам веществ с молекулами циклической формы.
К линии III тяготеют точки, соответствующие парам веществ с ассоциированными молекулами, а к линии I – с неассоциированными молекулами.
Можно заметить также, что близкие по молекулярной массе вода (точка 23) и аммиак (точка 24) имеют существенно разные значения bj, что можно связать с различием форм их молекул (треугольной и пирамидальной, соответственно [2]).
Однако, эти предположения требуют серьезной проверки, что и планируется в дальнейшем с привлечением обширного материала из [23].
Список литературы
1. Бесков С.Д. Технохимические расчеты. – М.: Высш. шк., 1966. – 520 с.
2. Бретшнайдер С. Свойства газов и жидкостей. – М.-Л.: Химия, 1966. – 535 с.
3. Бретшнайдер С. Общие основы химической технологии: Пер с польск. – Л.: Химия, 1977. – 503 с.
4. Циборовский Я. Основи процессов химической технологии: Пер. с польск. – Л.: Химия, 1967. – 719 с.
5. Флореа О., Смигельский О. Расчеты по процессам и аппаратам химической технологии. – М.: Химия, 1971. – 448 с.
6. Плановский А.Н. Николаев П.И. Процессы и аппараты химической и нефтехимической технологии. – М.: Химия, 1987. – 496 с.
7. Органические растворители. Физические свойства и методы очистки: Пер. с англ / А. Вайсбергер, Э. Проскауэр, Дж. Риддик, Э. Тупс. – М.: Изд-во иностр. лит-ры, 1958. – 520 с.
8. Рид Р., Праусниц Дж., Шервуд Т. Свойства газов и жидкостей: Справ. пособие: Пер. с англ. – Л.: Химия, 1982. – 592 с.
9. Коробчанский И.Е., Кузнецов М.Д. Расчеты аппаратуры для улавливания химических продуктов коксования. – Харьков-М.: Гос. научн.-техн. изд-во лит-ры по черной и цветной металлургии, 1952. – 288 с.
10. Изобарное равновесие жидкость-пар для системы этил-3-гидроксибутират-этилкротонат-этанол при 101.325 кПа / Wang Yan-fei, Ma Pei-sheng, Wang Ru-fan, Jia Yan-zong, Sun Yi. // J. Chem. Eng. Chin. Univ. – 2007. – Т.21.– № 1. – C.9-13.
11. Isothermal vapor-liquid equilibria and excess enthalpies of (propyl ethanoate+heptane), (propyl ethanoate+cyclohexane), and (propyl ethanoate+1-hexene) / Negadi Latifa, Belabbaci Aouicha, Kaci Ahmed Ait, Jose Jacques // J. Chem. and Eng. Data. – 2007. – Т.52. – № 1. – C.47-55.
12. Malanowski Stanislaw K. Vapor-liquid equilibrium for benzaldehyde with 1-methylethylbenzene and for 2-methyl-propan-2-ol with 2,4,4-trimethyl-1-pentene // J. Chem. and Eng. Data. – 2007. – Т.52. – № 1. – C.239-243.
13. Оптимальное управление процессами пиролиза парафиновых углеводородов C2-C4 и их смесей / А.М. Алиев, А.З. Таиров, А.М. Гусейнова, Н.Р. Исмаилов // Математические методы в технике и технологиях (ММТТ-24): Сборник трудов24 Международной научной конф. – Киев. – 2011. – Т.3. – C.33-36.
14. Солодяк Л.Й., Левуш С.С. Вплив парцiального тиску на селективнiсть високотемпературного перетворення тетрафлуоретилену // Вопр. химии и хим. технологии. – 2011. – № 2. – C.11-13.
15. Мирзалиев А. Г., Ли Р. Ч.. Влияние технологических параметров регенерации цеолитов на эффективность сероочистки // Узб. журн. нефти и газа. – 2011. – № 4. – C.47-48.
16. Полимеризация этилена с использованием нанесенного неметаллоценового катализатора для получения сшиваемых пероксидами полиэтиленовых труб / Kan Lin, Li Chuanfeng, Zuo Shengwu, Mei Li. // Petrochem. Technol. – 2012. – Т.41. – № 2. – C.199-203.
17. Molecular content of the deposition flux during reactive Ar/O2 magnetron sputtering of Al / Jon M. Andersson, Е. Wallin, Е.Р. Munger, U. Helmersson // Appl. Phys. Lett. – 2006. – Т.88. – № 5. – C.054101/1-054101/3.
18. Чжо Чжао. Корреляционный метод расчета давления насыщенного пара и коэффициентов разделения для элементоорганических соединений // Естеств. и техн. науки. – 2005. – № 6. – С.222-22.
19. Хальд А. Математическая статистика с техническими приложениями. – М.: Изд-во иностр. лит-ры, 1956. – 664 с.
20. Кендал М., Стьюарт А. Статистические выводы и связи. – М.: Наука, 1975. – 899 с.
21. Antoine C. Thermodynamique. – Tensions des vapours: nouvelle relation entre les tensions et les temperatures // Comptes rendus. – 1888. – T.107. – P.681-684.
22. Antoine C. Physique. – Tensions de diverses vapeurs.(Extrait.) // Comptes rendus. – 1888. – T.107. – P.836-837.
23. Сталл Д.Р. Таблицы давления паров индивидуальных веществ: Пер. с англ. – М.: Изд-во иностр. лит-ры. – 1949. – 71 с.
Поступила в редакцию 12.04.2013
Date: 2015-09-17; view: 737; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |