
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Строение атома
· Уравнение Шредингера для стационарных состояний в сферических координатах

где y = y (r, 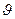 , j) — волновая функция; Е — полная энергия частицы; U — потенциальная энергия частицы (являющаяся функцией координат).
, j) — волновая функция; Е — полная энергия частицы; U — потенциальная энергия частицы (являющаяся функцией координат).
· В атоме водорода (или водородоподобном ионе) потенциальная энергия U(r) имеет вид
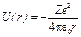 ,
,
где Z — зарядовое число; е — элементарный заряд; e0 — электрическая постоянная.
· Собственное значение энергии Еп электрона в атоме водорода
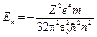
где ħ — постоянная Планка, п — главное квантовое число (n = 1,2,3,..)
· Символическая запись y-функции, описывающей состояние электрона в атоме водорода,
yn,l,m(r, 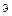 , j),
, j),
где п, l, m — квантовые числа: главное, орбитальное, магнитное.
Вероятность dW того, что электрон находится в области, ограниченной элементом объема dV, взятого в окрестности точки с координатами r, 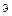 , j,
, j,
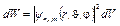 ,
,
где 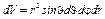 (в сферических координатах).
(в сферических координатах).
В s-состоянии (l = 0, m = 0 ) волновая функция сферически-симметричная (т. е. не зависит от углов 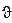 и j). Нормированные собственные y-функции, отвечающие s-состоянию (основному) и 2s-состоянию,
и j). Нормированные собственные y-функции, отвечающие s-состоянию (основному) и 2s-состоянию,
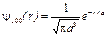 и
и 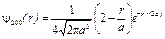
или в атомных единицах
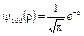 и
и 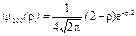
где в качестве единицы длины принят боровский радиус 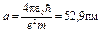 . При таком выборе единицы длины расстояние
. При таком выборе единицы длины расстояние
от ядра r = r/а будет выражаться в безразмерных единицах длины, называемых атомными единицами.
Вероятность dW найти электрон в атоме водорода, находящемся в s-состоянии, в интервале (r, r+dr) одинакова по всем направлениям и определяется формулой
D W = [yn, 0, 0 (r)]2 4p r2 dr
· Орбитальные момент импульса и магнитный момент электрона:

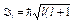 ,
, 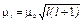 ,
,
где l — орбитальное квантовое число, которое может принимать значения 0, 1, 2,..., (п— 1); mв — магнетон Бора:
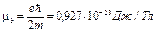
· Проекции орбитальных момента импульса и магнитного момента на направление внешнего магнитного поля (совпадающего с осью Z):
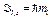
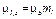
· Гиромагнитное отношение для орбитальных магнитного и механического моментов
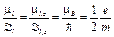 .
.
· Спин * и спиновый магнитный момент электрона:
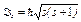 ,
, 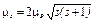 ,
,
где s— спиновое квантовое число (s = ½)
· Проекции спиновых момента импульса и магнитного момента на направление внешнего магнитного поля (совпадающего с осью Z):
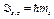 ,
, 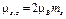
где ms — спиновое магнитное квантовое число (ms = -1/2, +1/2) Гиромагнитное отношение для спиновых магнитного и механического моментов
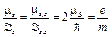
· Распределение электронов по состояниям в атоме записывается с помощью спектроскопических символов:
| Значение побочного квантового числа | ||||||||
| Спектроскопичес-кий символ | s | р | d | f | g | h | i | k |
Электронная конфигурация записывается следующим образом:
число, стоящее слева перед спектроскопическим символом, означает главное квантовое число п, а сам спектроскопический символ отвечает тому или иному значению орбитального квантового числа l (например, обозначению 2 р отвечает электрон с п = 2 и l = 1; 2 р 2 означает, что таких электронов в атоме 2, и т. д.).
· Принцип Паули. В атоме не может находиться два (и более) электрона, характеризуемых одинаковым набором четырех квантовых чисел: n, l, ml, ms
· Полный момент импульса электрона
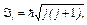
где j — внутреннее квантовое число (j = l + 1/2, l — 1/2).
· Полный орбитальный момент атома
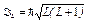 ,
,
где L — полное орбитальное квантовое число.
· Полный спиновый момент атома
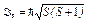 ,
,
где S — полное спиновое квантовое число.
· Полный момент импульса атома
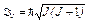 ,
,
где J — полное внутреннее квантовое число.
· Символическое обозначение состояния атома (спектральный терм)
2S+1LJ,
где 2S+1 —мультиплетность. Вместо полного орбитального квантового числа L пишут символ в соответствии с таблицей:
| Значение | ||||||
| Символ | S | Р | D | F | G | И |
*Такой барьер называют также потенциальной ступенью, если при переходе из области I в область II потенциальная энергия частицы уменьшается.
* Спином называется собственный момент импульса электрона и других элементарных частиц. Спин не связан с перемещением частицы как целого и имеет квантовую природу. Спин выражается в единицах постоянной Планка ħ.
Date: 2015-09-05; view: 228; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |