
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

АТОМНО-МОЛЕКУЛЯРНЕ ВЧЕННЯ
НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ УКРАЇНИ
“КИЇВСЬКИЙ ПОЛІТЕХНІЧНИЙ ІНСТИТУТ”
Хімія
АТОМНО – МОЛЕКУЛЯРНЕ ВЧЕННЯ. ОСНОВНІ ПОНЯТТЯ АТОМНО – МОЛЕКУЛЯРНОГО ВЧЕННЯ.
СТЕХІОМЕТРИЧНІ ЗАКОНИ ХІМІЇ.
КЛАСИ НЕОРГАНІЧНИХ СПОЛУК.
Навчальний електронний посібник
для студентів фізико-математичного факультету
Рекомендовано Методичною радою НТУУ “КПІ”
Київ
НТУУ “КПІ”
Навчальний електронний посібник "Хімія. Атомно-молекулярне вчення. Основні поняття атомно-молекулярного вчення. Стехіометричні закони хімії. Класи неорганічних сполук." для студентів фізико-математичного факультету./ Укладачі: Шульженко О.О., Шпак А.Є., Гріщенко Л.П. –К.: НТУУ "КПІ", 2013. -89 с.
Навчальний електронний посібник
Хімія
Атомно-молекулярне вчення. Основні поняття атомно-молекулярного вчення. Стехіометричні закони хімії. Класи неорганічних сполук
для студентів фізико-математичного факультету
Укладачі Шульженко Олена Олександрівна, ст. викл.
Шпак Арсеній Євгенович, асистент
Гріщенко Лариса Петрівна, асистент
Відповідальний
редактор О.О. Андрійко, д. х. н., зав. кафедри загальної та неорганічної хімії ХТФ НТУУ “КПІ”
Рецензент Г.Г. Жалніна, канд. хім. наук, доц. кафедри хімії факультету природничих наук Національного університету “Києво-Могилянська академія”
ЗМІСТ
Зміст…………………………………………………………………………...3
Вступ…………………………………………………………………………..4
Атомно-молекулярне вчення…..………………………………………….....5
Основні поняття атомно-молекулярного вчення.…………………………..8
Стехіометричні закони хімії
Закон збереження маси………………………………………………...…..….14
Закон сталості складу……..……………………………………...………..…..14
Закон еквівалентів…………………………………...……………………..…..15
Закони ідеальних газів…………………………………………..……….....….26
Класи неорганічних сполук……………………………………………..……..35
Завдання на додаткову роботу………………………………………..…...…..73
Список рекомендованої літератури………………………………...….……...82
Додатки
1. Додаток А. Назви деяких простих речовин і елементів………….…...84
2. Додаток Б. Значення деяких фундаментальних сталих ………….…..85
3. Додаток В. Розчинність кислот, основ та солей у воді.....……………86
4. Додаток Г. Таблиця електронегативностей……………………………88
5. Додаток Д. Періодична система елементів Д.І.Менделєєва…………..89
ВСТУП
Навчальний посібник „Атомно-молекулярне вчення. Основні поняття атомно-молекулярного вчення. Стехіометричні закони хімії. Класи неорганічних сполук.” складений у відповідності до програми з загальної хімії для технологічних спеціальностей вищих учбових закладів і призначені для організації самостійної роботи студентів перед лабораторними заняттями з хімії, контролю знань та підготовки студентів до контрольних робіт.
До кожної теми подано теоретичні відомості, які необхідні для самостійного виконання задач, завдання для домашньої підготовки та приклади розв’язання цих завдань.
При підготовці теми необхідно вивчити програмні питання, користуючись даним посібником та за літературними джерелами, вказаними в кінці даного посібника. Потім треба письмово розв’язати задачі, дати обгрунтовані відповіді на поставлені запитання.
АТОМНО-МОЛЕКУЛЯРНЕ ВЧЕННЯ
Атомно-молекулярне вчення розвив і вперше застосував в хімії видатний російський вчений М.В.Ломоносов. Основні положення його вчення викладені у роботі „Елементи математичної хімії” (1741) та ін. Суть вчення Ломоносова зводиться до положень:
1. Всі речовини складаються з „корпускул” (молекул).
2. Молекули складаються з „елементів” (атомів).
3. Частинки – молекули та атоми – знаходяться у безперервному русі. Теплота складається з внутрішнього руху цих частинок.
4. Молекули простих речовин складаються з однакових атомів, молекули складних речовин – з різних атомів.
Через 67 років після вказаної роботи Ломоносова вийшла книга англійського вченого Д.Дальтона „Нова система хімічної філософії” (1808), де були викладені основні положення хімічної атомістики. Дальтон вперше визначив атомні маси відомих тоді елементів та увів знаки для позначення атомів.
Але Дальтон заперечував існування молекул у простих речовин. Він вважав, що прості речовини складаються тільки з атомів і лише складні речовини – з „складних атомів” (у сучасному розумінні – молекул).
Сучасні формулювання було прийнято в 1860 р. на І міжнародному конгресі хіміків в м. Карлсруе, засновані на вченнях Епікура, Дальтона, Ломоносова:
1. Усі речовини є сукупністю молекул або кристалами, які побудовані з атомів.
2. Атоми одного елемента однакові між собою, але відрізняються від атомів іншого елемента.
3. Атом є найменшою частинкою елемента і носієм його хімічних властивостей; його не можна розкласти хімічним способом; під час хімічних перетворень атоми не з’являються з нічого і нікуди не зникають, змінюються лише способи зв’язування атомів.
4. Внаслідок взаємодії атомів утворюються молекули: гомоядерні у простих речовин 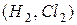 , гетероядерні – у складних
, гетероядерні – у складних 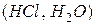 .
.
5. Під час фізичних явищ (кипіння, плавлення, ін.) молекули зберігаються, під час хімічних перетворень – руйнуються.
6. Хімічні реакції полягають в утворенні нових речовин із тих самих атомів, з яких складалися вихідні речовини.
Згідно сучасних уявлень, з молекул складаються речовини у газоподібному стані. У твердому (кристалічному) стані з молекул складаються лише речовини, які мають молекулярну структуру, наприклад органічні речовини, неметали (за невеликим виключенням), оксид карбону (ІV), вода. У молекулярних кристалах відстані між окремими групами атомів більші, ніж між атомами у цих групах, тобто у їхній структурі можна виділити поодинокі молекули. Сили, що діють між атомами у молекулі більші, ніж між окремими молекулами у кристалі.
Але більшість твердих неорганічних речовин не мають молекулярної структури. Вони складаються не з молекул, а з інших частинок (іонів, атомів) та існують у вигляді макротіл (кристали хлориду натрію, кварц, залізо, ін.). Наприклад, солі, оксиди та сульфіди металів, алмаз, кремній, метали. Формули речовин з немолекулярною будовою, наприклад 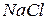 , лише відображають співвідношення між частинками, що їх утворюють. Тому для таких речовин використовують поняття формульної одиниці, яка включає найменшу кількість частинок, необхідних для відображення цього співвідношення.
, лише відображають співвідношення між частинками, що їх утворюють. Тому для таких речовин використовують поняття формульної одиниці, яка включає найменшу кількість частинок, необхідних для відображення цього співвідношення.
У речовин з молекулярною структурою хімічний зв’язок між молекулами менш міцний, ніж у речовин з атомною структурою. Тому вони мають порівняно низькі температури плавлення та кипіння. У речовин з немолекулярною структурою хімічний зв’язок між частинками міцний. Тому вони мають високі температури плавлення та кипіння.
Date: 2015-09-05; view: 678; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |