
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Методика эксперимента. В калорический стакан отмеряют пипеткой 50 мл воды и по 50 мл 30%-ного раствора H2SO4 и 1,25%-ного раствора KMnO4 из бюреток
В калорический стакан отмеряют пипеткой 50 мл воды и по 50 мл 30%-ного раствора H2SO4 и 1,25%-ного раствора KMnO4 из бюреток. В ампулу помещают навеску щавелевой кислоты m 0,2…1,0 г, взвешенной на аналитических весах. Затем производится определение теплоты реакции и теплоёмкости системы, также как и в работе 2.
Затем вычисляют молярную теплоту окисления:
 , (22)
, (22)
где DT – изменение температуры в ходе реакции, C – теплоёмкость системы.
Для определения полноты протекания реакции используют теоретический расчёт теплоты реакции с использованием данных по теплоте разбавления (рис.4, 5):
1) теплоты образования веществ, находящихся в растворе, определяются по графикам зависимости этих величин от концентрации раствора, ∆H = f (m), где:
m – количество молей воды, приходящееся на 1 моль растворённого вещества. В изучаемой реакции в растворе находятся KMnO4, K2SO4, H2SO4, MnSO4 и CO2. Из них:
а) для KMnO4 и K2SO4 можно считать величины ∆H независящими от концентрации и равными, соответственно, 769,65 кДж/моль и 1408,96 кДж/моль;
б) для H2SO4 и MnSO4 – определить величины ∆H из графиков (рис.4);
в) углекислота, выделяющаяся в результате реакции окисления, может находиться либо только в растворе, либо частично в растворе, а частично в газовой фазе, в зависимости от растворимости её при данной температуре. Вычислив количество выделившейся в реакции углекислоты, можно установить с помощью графика зависимости растворимости её (m – число мл CO2, растворяющееся в 1 мл воды, приведённое к нормальным условиям) от температуры (рис.5), сколько её находится в растворе и сколько в газовой фазе.
Величину  в растворе принять равной –412.92 кДж/моль, а в газовой фазе
в растворе принять равной –412.92 кДж/моль, а в газовой фазе  = –393.36 кДж/моль.
= –393.36 кДж/моль.
2) Величину 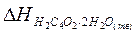 принять равной –1426.3 кДж/моль.
принять равной –1426.3 кДж/моль.
3) Теплоту растворения C2O4H2∙2H2O принять равной –35.31 кДж/моль – интегральной теплоте растворения 1 моля щавелевой кислоты в избытке воды, что соответствует условиям данной работы, в которой на один моль щавелевой кислоты в растворе приходится 1000…5000 молей воды.
4)  принять равной –285.85 кДж/моль.
принять равной –285.85 кДж/моль.
Date: 2015-09-19; view: 232; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |