
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глава 5
Контактное окисление аммиака.
В настоящее время практически единственным способом получения азотной кислоты является контактное окисление аммиака кислородом воздуха с последующим поглощением оксидов азота водой. Стадия конверсии аммиака во многом определяет показатели всего производства азотной кислоты.
Окисление аммиака кислородом воздуха до оксида азота (II) является первой стадией процесса получения азотной кислоты. Наряду с основной реакцией окисления аммиака до оксида азота (II)
4NH3 + 5O2 =4NO + 6H2O + Q (5.1.)
происходит окисление аммиака до элементарного азота и оксида азота (I):
4NH3 + 3O2 =2N2 + 6H2O +Q (5.2.)
4NH3 + 4O2 = 2N2O + 6H2O +Q (5.3.)
При определенных условиях возможна диссоциация аммиака:
2NH3 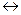 N2 + 3H2 -Q (5.4.)
N2 + 3H2 -Q (5.4.)
Таким образом, процесс окисления аммиака является сложным. О равновесном состоянии реакций можно судить по величине констант равновесия. Известно, что для обратимых реакций константы равновесия имеют значения в пределах 10-2-102.
Константы равновесия реакций (5.1.)-(5.3.) имеют значения 1053 (5.1.), 1067 (5.2.) и 1041, все эти реакции необратимы.
Так как процесс окисления аммиака сложный, то выбор условий проведения процесса будет определяться необходимостью направить взаимодействие исходных веществ по пути образования оксида азота (II). Учитывая, что рассматриваемые реакции необратимые, этого можно достичь только путем создания условий, при которых скорость основной реакции будет значительно превышать скорости побочных реакций. И чем значительней эта разность скоростей, тем выше практический выход оксида азота (II).
Окисление аммиака до оксида азота (II) не происходит в газовой фазе даже при очень высоких температурах из-за высокой энергии активации. Для ее снижения необходимы катализаторы, активно адсорбирующие кислород.
В промышленности чаще всего применяют платиново-родиевые катализаторы в виде сеток.
Окисление аммиака на этом катализаторе протекает очень быстро, при времени контактирования порядка 10-4 с., а выход NO составляет 98%.
Неплатиновые катализаторы из оксидов железа и хрома, дают также высокие выходы 96%, но скорость процесса снижается в 100 раз.
Таким образом, процесс окисления аммиака до оксида азота (II) является сложным, необратимым, экзотермическим, гетерогенно-каталитическим.
Так как химическое превращение аммиака протекает очень быстро, скорость всего процесса будет определяться скоростью диффузии реагирующих веществ из объема к поверхности катализатора. Т.е. процесс идет во внешнедиффузионной области.
Поскольку, процесс в промышленности осуществляют с избытком кислорода, скорость процесса определяется скоростью диффузии аммиака к поверхности катализатора.
Окисление аммиака на платиновом катализаторе протекает в несколько стадий:
1) диффузия реагирующих веществ из газового объема к поверхности катализатора,
2) активированная абсорбция кислорода на активных центрах катализатора с образованием перекисного комплекса (катализатор-кислород), который затем образует новый переходный комплекс (катализатор-кислород-аммиак),
3) распад переходного комплекса с образованием оксида азота (II) и воды,
4) десорбция продуктов реакции с поверхности катализатора,
5) диффузия продуктов реакции в газовый объем.
Выбор оптимальных условий процесса.
Выбор оптимальных условий для сложного необратимого каталитического процесса сводится к созданию такого технологического режима, который обеспечивал бы высокую скорость основной реакции. Это в первую очередь определяется правильным выбором катализатора и условий, обеспечивающих его высокую селективность и активность.
Date: 2015-09-18; view: 940; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |