
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

В. Изотермический процесс
1. Изотермическим называется процесс, протекающий при постоянной температуре:
Т=const (6.20)
или pv=const. (6.21)
2. Из (6.21) получим
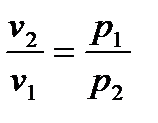 . (6.22)
. (6.22)
3. Работу изменения объема вычислим по формуле 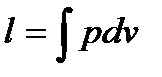 , подставляя вместо р его выражение из уравнения
, подставляя вместо р его выражение из уравнения :
 .
.
Используя (6.22), получим
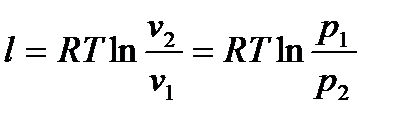 . (6.23)
. (6.23)
С помощью уравнения 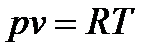 можно формулу работы представить еще в виде
можно формулу работы представить еще в виде
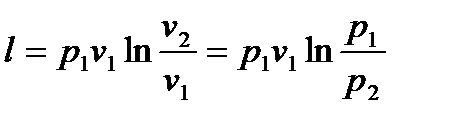 . (6.24)
. (6.24)
Для вычисления технической работы вспомним ее выражение 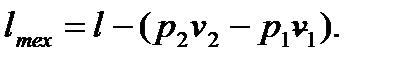 Но, согласно уравнению (6.21), скобка в правой части последней формулы обращается в нуль, поэтому
Но, согласно уравнению (6.21), скобка в правой части последней формулы обращается в нуль, поэтому 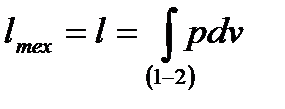 . Следовательно, для технической работы изотермического процесса можно использовать формулы (6.23) и (6.24):
. Следовательно, для технической работы изотермического процесса можно использовать формулы (6.23) и (6.24):
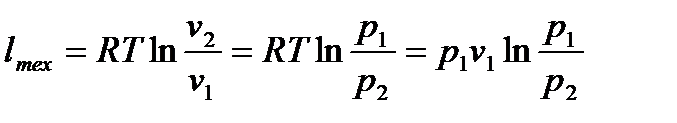 . (6.25)
. (6.25)
4. Для определения количества теплоты используем уравнение 1-го закона термодинамики (dq = du + dl). Принимая во внимание, что в изотермическом процессе dt=0, получим dq=dl или q=l. Таким образом, при изотермическом процессе с идеальным газом вся подведенная теплота идет на совершение работы и ее количество можно вычислить по формуле (6.25). Ранее для определения количества теплоты мы использовали теплоемкость соответствующего процесса. В случае изотермического процесса этот путь невозможен. Дело в том, что определение теплоемкости (5.9) для этого процесса не имеет смысла, так как для элементарного процесса dq≠0, а знаменатель дроби (5.9) dt=0. Если процесс по характеру приближается к изотермическому, то его теплоемкость стремится к бесконечности.
5. В соответствии с формулами 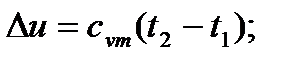 и Δ h = cpm (t2 - t1), внутренняя энергия и энтальпия идеального газа при изотермическом процессе не изменяются: u=const, h=const.
и Δ h = cpm (t2 - t1), внутренняя энергия и энтальпия идеального газа при изотермическом процессе не изменяются: u=const, h=const.
Изменение энтропии найдем, проинтегрировав уравнение 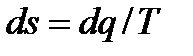 с учетом (6.20):
с учетом (6.20):
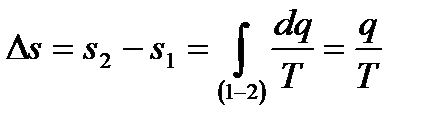 . (6.26)
. (6.26)
Последнее выражение является совершенно общим, т.е. справедливо для любых веществ. Из него, между прочим, выводится общее выражение для количества теплоты изотермического процесса:
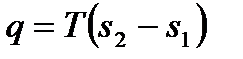 , (6.27)
, (6.27)
которое можно применять, в отличие от формулы (6.25), не только для идеального газа, но и для рабочих тел любой природы. В случае идеального газа из уравнений (6.25) и (6.26) получим
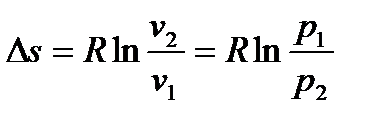 . (6.28)
. (6.28)
6. Как следует из уравнения процесса (6.20), изотерма в pv - диаграмме представляет собой дугу равнобочной гиперболы, а в Ts -диаграмме изображается отрезком горизонтальной прямой, согласно уравнению (6.23) (рис. 6.4).
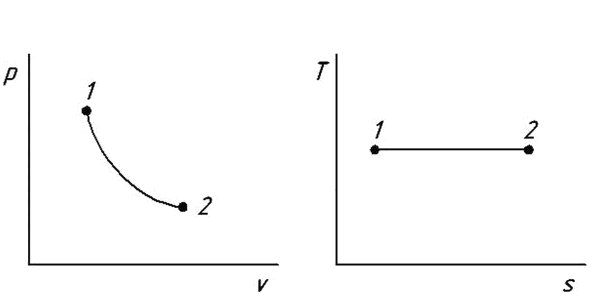
Рис. 6.4. Изображение изотермического процесса.
Формула (6.28) показывает, что при возрастании объема (v2>v1) энтропия газа в изотермическом процессе также возрастает (Δs> 0). Следовательно, направлению изотермы в pv - диаграмме вправо соответствует направление в Ts -диаграмме также вправо. Формулу (6.28) удобно использовать для решения вопроса о расположении в Ts - диаграмме изобар разного давления и изохор разного объема. Пусть в Ts - диаграмме проведены две изобары соответствующие давлениям p1 и p2 (рис. 6.5,а).
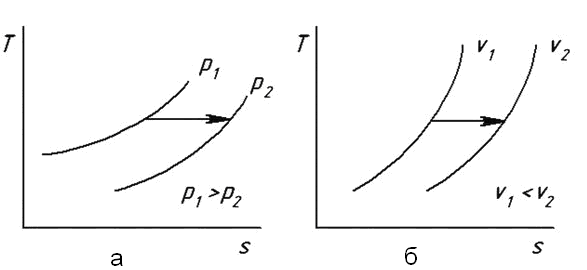
Рис. 6.5. Расположение различных изобар и изохор в TS- координатах
Проведем между двумя изобарами отрезок изотермы, который будем считать направленным вправо. Так как при этом, очевидно, Δs> 0, согласно формуле (6.28) должно быть p1>p2. Если упомянутый отрезок изотермы располагать на разных уровнях, то, поскольку на каждой из двух рассматриваемых кривых давление не меняется, длина отрезка изотермы, согласно той же формуле (6.28), также не будет изменяться. Эти рассуждения приводят к следующему заключению: изобары разного давления в Ts - диаграмме для случая идеального газа являются эквидистантными линиями (в горизонтальном направлении), причем изобары большего давления расположены левее изобар меньшего давления. Аналогичные рассуждения в случае изохор дают следующее правило: изохоры разного удельного объема в Ts - диаграмме для идеального газа являются эквидистантными линиями (в горизонтальном направлении), причем изохоры большего объема расположены правее изохор меньшего объема (рис. 6.5,б).
7. Изотермический процесс с газом в технике не используется ввиду сложности его практического осуществления. Этот процесс имеет большое теоретическое значение. Часто встречается в технике изотермический процесс с водяным паром, что связано со специфическими свойствами этого рабочего тела в гетерогенном (двухфазном) состоянии.
Date: 2015-09-18; view: 1211; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |