
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основи
Основи – з позиції теорії електролітичної дисоціації це складні речовини, які у водних розчинах дисоціюють тільки на аніони гідроксильних груп та катіони металів.
Наприклад: NaOH→ Na+ + OH-
Ba(OH)2→ BaOH+ + OH-
BaOH+ → Ba+2 + OH-
Основи бувають розчинні і нерозчинні. Розчинні називаються ще лугами. По кількості гідроксильких груп основи бувають одно-, двох-, трьох- і багатокислотні. КОН – однокислотне, Са(ОН)2 – двукислотне, Al(OH)3 – трьохкислотне.
Назвва основ утворюється із назви металу в родовому відмінку і слова “гідроксид”: NaOH – натрій гідроксид, Са(ОН)2 – кальцій гідроксид.
Коли метали мають переміну ступінь окислення, то в дужках позначають римською літерою ступень окислення металу в цій основі: Fe(OH)2 – ферум гідроксид (ІІ), Fe(OH)3 – ферум гідроксид (ІІІ).
Добування:
1. Взаємодією активних металів з водою:
2Na + 2H2O = 2NaOH + H2
2. Взаємодією оксидів з водою:
CaO + H2O = Ca(OH)2
3. Електролізом водних розчинів солей лужних металів:
2NaCl + 2 H2O = 2NaOH + H2 + Cl2
4. Взаємодією лугів з солями:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Хімічні властивості.
1. З кислотами:
2NaOH + H2SO4 = Na2SO4 + 2H2O
2. З кислотними оксидами:
Ca(OH)2 + SO3 = CaSO4 + H2O
3. З амфотерними оксидами (для лугів):
2KOH + ZnO = K2ZnO2 + H2O
4. З амфотерними металами (для лугів):
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
5. З солями (для лугів):
Ba(OH)2 + Na2SO4 = BaSO4¯ + 2NaOH
6. Термічне розкладення:
Ca(OH)2 = CaO + H2O
АМФОЛІТИ.
Важкорозчинні у воді гідроксиди характеризуються тим, що розчинна їх частина може вести себе як основа, або як кислота в залежності від рН середовища. В кислому середовищі амфоліти ведуть себе як основи, в лужному середовищі – як кислоти.
 2Н+ + ZnO
2Н+ + ZnO 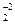 ↔ H2ZnO2=Zn(OH)2 ↔ Zn+2 + 2OH-
↔ H2ZnO2=Zn(OH)2 ↔ Zn+2 + 2OH-
кислота осадок основа
Zn(OH)2 + 2HCl → ZnCl2 + H2O
H2ZnO2 + NaOH → Na2ZnO2 + 2H2O
СОЛІ
Солі – з позиції теорії електролітичної дисоціації це складні речовини, які у водних розчинах дисоціюють на катіони металів (або амонію) і аніони кислотного залишку, а іноді, крім них, і на іони гідрогену і гідроксилу. Солі це продукт повного або часткового заміщення атомів гідрогену в молекулі кислоти на метал, або заміщення гідроксогруп в основі на кислотний залишок.
NaCl → Na+ + Cl-
KNO3 → K++ NO 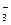
Солі бувають: - нормальні (середні) – NaCl, CaSO4, KNO3;
- гідросолі (кислі) – KHSO4, NaH2PO4, Na2HPO4;
- гідроксосолі (основні) – CaOHCl, AlOHSO4, CaOHNO3;
- подвійні – KAl(SO4)2;
- змішані – CaClClO;
- комплексні – [Cu(NH3)4]SO4.
В назвах солей кисневмісних кислот використовують закінчення – іт,- ат,-ід.
- іт – коли елемент, утворюючий кислоту, проявляє низьку ступінь окислення. Наприклад: K2SO3 – калій сульф іт;
- ат – коли ступінь окислення вища. Наприклад: Na2SO4 – натрій сульф ат;
- ід – в назвах солей безкисневих кислот. Наприклад: ZnS – цинк сульф ід;
- KHSO4 – калій гідросульфат;
- Na2HPO4 – калій дігідросульфат;
- CaOHCl – кальцій гідроксохлорід.
Добування:
1. Взаємодією металів з неметалами, з кислотами, з солями:
2Na + Cl2 = 2NaCl
Zn + 2HCl = ZnCl2 + H2
Fe + CuSO4 = FeSO4 + Cu
2. Взаємодією оксидів з кислотами та основами:
Na2O + 2HCl = 2NaCl + H2O
SO3 + Ca(OH)2 = CaSO4 + H2O
3. В реакції нейтралізації:
2NaOH + H2SO4 = Na2SO4 + 2H2O
4. Взаємодією солей з основами, кислотами та іншими солями:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
AgNO3 + NaCl = AgCl + NaNO3
Хімічні властивості.
1. Взаємодія з металами, солями, лугами, кислотами (див. вище).
2. Розкладення при прожарюванні (див. одержання оксидів).
Date: 2015-09-02; view: 500; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |