
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Осмотическое давление
диффузное давление, термодинамический параметр, характеризующий стремление раствора к понижению концентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворённого вещества и растворителя. 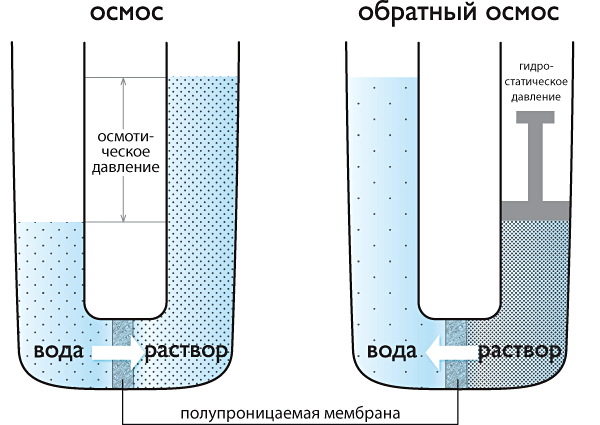
Если раствор отделен от чистого растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия? осмотическое всасывание растворителя через мембрану в раствор. В этом случае О. д. становится доступной для прямого измерения величиной, равной избыточному давлению, приложенному со стороны раствора при осмотическом равновесии. О. д. обусловлено понижением химического потенциала растворителя в присутствии растворённого вещества. Тенденция системы выравнивать химические потенциалы во всех частях своего объёма и перейти в состояние с более низким уровнем свободной энергии вызывает осмотическое (диффузионный) перенос вещества.
О. д. в идеальных и предельно разбавленных растворах не зависит от природы растворителя и растворённых веществ; при постоянной температуре оно определяется только числом «кинетических элементов»? ионов, молекул, ассоциатов или коллоидных частиц? в единице объёма раствора.
Первые измерения О. д. произвёл В. Пфеффер (1877), исследуя водные растворы тростникового сахара. Его данные позволили Я. X. Вант-Гоффу установить (1887) зависимость О. д. от концентрации растворённого вещества, совпадающую по форме с Бойля? Мариотта законом для идеальных газов. Оказалось, что О. д. (p) численно равно давлению, которое оказало бы растворённое вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объём, равный объёму раствора.
Для весьма разбавленных растворов недиссоциирующих веществ найденная закономерность с достаточной точностью описывается уравнением: pV = nRT, где n? число молей растворённого вещества в объёме раствора V; R? универсальная газовая постоянная; Т? абсолютная температура. В случае диссоциации вещества в растворе на ионы в правую часть уравнения вводится множитель i > 1, коэффициент Вант-Гоффа; при ассоциации растворённого вещества i < 1. О. д. реального раствора (p?) всегда выше, чем идеального (p??), причём отношение p?/ p?? = g, называемое осмотическим коэффициентом, увеличивается с ростом концентрации.
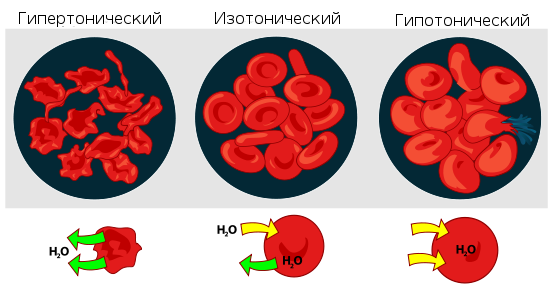
Растворы с одинаковым О. д. называется изотоническими или изоосмотическими. Так, различные кровезаменители и физиологические растворы изотоничны относительно внутренних жидкостей организма. Если один раствор в сравнении с другим имеет более высокое О. д., его называют гипертоническим, а имеющий более низкое О. д.? гипотоническим.
Изотонические растворы (изоосмотические растворы) — растворы, имеющие одинаковое осмотическое давление. Если два раствора не изотоничны, то раствор с большим осмотическим давлением (см.) называют гипертоническим, а раствор с меньшим осмотическим давлением — гипотоническим.
В физиологии и медицине изотонические растворы принято называть растворы, осмотическое давление которых равно осмотическому давлению крови, лимфы. Попадая в организм, изотонические растворы не нарушают нормального функционирования клеток и тканей. Для человека изотонические растворы будут, например, 0,9% раствор хлорида натрия, 5% раствор глюкозы. Изотонические растворы хлорида натрия вводят внутривенно для увеличения кровяного давления после больших кровопотерь, для возмещения объема жидкости в организме при сильном обезвоживании (ожоговая болезнь, обильные рвоты и т. п.). Изотонические растворы, приближающиеся по составу, величине рН, буферным и другим свойствам к сыворотке крови, называемые физиологическими растворами, используются в качестве кровезаменителей.
Гипотонические растворы (греч, hypo- + tonos напряжение) - растворы, осмотическое давление к-рых ниже осмотического давления плазмы крови.
При прямом воздействии этих растворов на ткани вследствие разницы осмотического давления в системе раствор-ткань происходит перемещение воды в клетки, в результате чего клетки и ткани набухают. При введении в сосуды Г. р. могут вызвать гемолиз эритроцитов. В связи с этим при необходимости внутривенного введения Г. р. предварительно определяют осмотическую резистентность эритроцитов. При приеме внутрь Г. р. вызывают увеличение диуреза. В мед. практике Г. р. имеют ограниченное применение. Так, Г. р. натрия хлорида (0, 6%) иногда используется для приготовления р-ров местных анестетиков в целях уменьшения всасывания последних в кровь.
Гипертонические растворы, растворы, осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях. В зависимости от функциональной, видовой и экологической специфики клеток осмотическое давление в них различно, и раствор, гипертоничный для одних клеток, может оказаться изотоничным или даже гипотоничным для др. При погружении растительных клеток в Гипертонические растворы он отсасывает воду из клеток, которые уменьшаются в объёме, а затем дальнейшее сжатие прекращается и протоплазма отстаёт от клеточных стенок (см. Плазмолиз). Эритроциты крови человека и животных в Гипертонические растворы также теряют воду и уменьшаются в объёме. Гипертонические растворы в сочетании с гипотоническими растворами и изотоническими растворами применяют для измерения осмотического давления в живых клетках и тканях.
Date: 2015-09-02; view: 674; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |