
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Кондуктометрический метод анализа
Кондуктометрия - это сов-ть электрохим. методов анализа, основанных на измер. удельной электропроводности растворов электролитов.
Любое вещ-во характер. своим электр. сопротивлением (R-{Ом}). Величина обратная сопротивлению называется электропроводностью или электрической проводимостью (G-{См}). Для раствора электролита, находящегося между двумя электродами, площадь поверхности которых равна S и расстояние между которыми равно l:

Удельная электропроводность 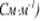 численно равна силе тока, проходящего через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1В на единицу длины.
численно равна силе тока, проходящего через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1В на единицу длины.
Удельная электропроводность связана с молярной концентрацией эквивалента вещества (моль/л): K = 1/ρ
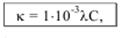 эквивалентная электропроводность –
эквивалентная электропроводность – 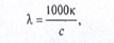
Измерение аналитического сигнала. Контактные кондуктометрические измерения проводят в ячейке для измерения электропроводности. Простейшая ячейка предст. собой стеклян.сосуд с двумя плоскопараллел. платиновыми электродами. Ячейку подключают к источнику переменного тока с частотой около 1000 Гц. Сопротивление р-ра можно измерять с пом. моста Уитстона.
Кондуктометрическое титрование основано на изменении удельной электропроводности раствора в зависимости от количества добавленного титранта. Точку эквивалентности опр. по изменению электропроводности раствора. Электропроводность измеряют после добавл.каждой порции титранта. Зависимость электропров. от кол-ва добавлен. титранта наз. кривой кондуктометрического титрования. Они имеют излом, соответствующий точке эквивалентности.
Преимущество метода- возможность определения вещ-в в многокомпонентных смесях в водных растворах.
 Кривая титрования HCl раствором NaOH
Кривая титрования HCl раствором NaOH
Понятие о высокочастотной кондуктометрии. Используется электр. ток высокой частоты. Электроды в ячейках для высокочаст. титрования не соприкасаются с анализир. р.р-ром. Сущ. два типа таких ячеек: емкостная (измеряют измен. частоты генератора в процессе титрования) и индуктивная (помещ. внутрь электромагн.катушки).
Потенциометрический метод анализа. Принцип работы, классификация и основные характеристики ион-селективных электродов. Обнаружение конечной точки титрования с использованием кривой титрования, ее производных и методом Грана.
Потенциометрическими называют методы анализа, основанные на измерении зависимости равновесного электродного потенциала от активности определяемого иона. При потенциометрических измерениях используется электрохимическая ячейка, работающая в режиме гальванического элемента. В состав ячейки входит индикаторный электрод, потенциал которого зависит от активности определяемого иона или от активности хотя бы одного из компонентов протекающей химической реакции, и электрод сравнения (чаще всего хлоридсеребряный), величина потенциала которого постоянна. Величина потенциала индикаторного электрода связана с активностью определяемого иона уравнением Нернста. Потенциометрия бывает прямая («ионометрия» - измеряют величину ЭДС и по ней находят концентрацию определяемого иона) и косвенная («потенциометрической титрование» - измеряют величину ЭДС, которая изменяется в ходе химической реакции между веществом и титрантом). Условия измерения аналитического сигнала:
- сила тока, протекающего через ячейку, должна быть равна 0;
- время, в течение которого проводится измерение, должно быть достаточным для достижения равновесия.
При измерении ЭДС в таких условиях можно считать, что величина соотношения аокисл/ aвосст у поверхности электрода равна величине этого соотношения в растворе.
Методы измерения ЭДС: компенсационный (Используют потенциометр Погендорфа) и некомпенсационный (Используют электронный вольтметр с очень большим входным сопротивлением). Приборы, позволяющие определять величину рХ (отрицательного логарифма активности иона Х в растворе), в комплекте с соответствующими ионо-селективными электродами, называются иономерами. Если прибор предназначен для измерения активности только катионов водорода, то его называют рН-метром.
Индикаторные электроды – металлические (имеют электронную проводимость) и неметаллические (имеют ионную проводимость). Ионоселективные электроды – это чувствительные элементы, потенциалы которых линейно зависят от lg активности определяемого иона в растворе. В состав ионоселективных электродов входит полупроницаемая мембрана, представляющая собой тонкую плёнку, отделяющую внутренний раствор (стандартный) от внешнего (анализируемого) и способную пропускать преимущественно ионы только одного вида.
Основные характеристики: интервал выполнения электродной функции, время отклика (Время, за которое потенциал электрода достигает постоянного значения. Чем меньше время отклика, тем лучше электрод) и селективность (Определяется потенциометрическим коэффициентом селективности, отражающим относительное влияние ионов А и В на величину мембранного потенциала. Чем меньше его величина, тем выше селективность электрода относительно иона А).
Виды ион-селективных электродов:
- с кристаллическими мембранами
- с жесткой матрицей (стеклянные, имеют стеклянную мембрану обладающую селективностью по отношению к определённому иону)
- с подвижными носителями (имеют жидкую мембрану - раствор ионообменника или "нейтрального переносчика" в
органическом растворителе, удерживаемый на пористом полимереили заключённыйв полимернуюматрицу)
- газочувствительные (датчики, состоящие из индикаторного электрода и электрода сравнения и имеющие газопроницаемую мембрану или воздушный зазор для отделения анализируемого раствора от тонкой плёнки
промежуточного раствора электролита)
- ферментные (датчики, в которых ИСЭ покрыт плёнкой, содержащей фермент, способный вызвать реакцию превращения субстрата с образованием веществ, на которые реагирует электрод)
Прямая потенциометрия - концентрацию определяемого вещества рассчитывают, исходя из величины ЭДС гальвани-
ческого элемента. индикаторным в прямой потенциометрии является ионоселективный электрод. Прямые потенциометрические измерения, в которых используется ионоселективный электрод, называются ионометрией.
Потенциометрическое титрование - метод анализа, основанный на регистрации измерения потенциала индикаторного электрода в процессе химической реакции между определяемым веществом и титрантом. Обнаруживают с использованием кривой титрования, ее производных, а также методом Грана. Конечной точке
титрования на исходной кривой титрования соответствует точка перегиба кривой. При использовании метода Грана конечной точке титрования соответствует точка пересечения прямых.
Date: 2015-08-15; view: 1023; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |