
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Физические свойства. Темно-синяя жидкость (при низких температурах), t°пл.= -102°C, t°кип.= 3,5°С; Выше t°кип
Темно-синяя жидкость (при низких температурах), t°пл.= -102°C, t°кип.= 3,5°С; Выше t°кип. разлагается на NO и NO2. N2O3 соответствует азотистой кислоте (HNO2), которая существует только в разбавленных водных растворах.
Получение NO2 + NO «N2O3
Химические свойства
Все свойства кислотных оксидов.
N2O3 + 2NaOH ® 2NaNO2(нитрит натрия) + H2O
Оксид азота (IV) N+4O2 двуокись азота, диоксид азота
Физические свойства
Бурый газ, запах резкий, удушливый, ядовит, t°пл.= -11,2°C, t°кип.= 21°С.
Получение
1. 2NO + O2 ® 2NO2
2. Cu + 4HNO3(конц.) ® Cu(NO3)2 + 2NO2 + 2H2O
Химические свойства
1. Кислотный оксид
· с водой 2NO2 + H2O ® HNO3 + HNO2
4NO2 + 2H2O + O2 ® 4HNO3
· со щелочами 2NO2 + 2NaOH ® NaNO2 + NaNO3 + H2O
2. Окислитель N+4O2 + S+4O2 ® S+6O3 + N+2O
3. Димеризация 2NO2(бурый газ)«N2O4(бесцветная жидкость)
Оксид азота (V) N2+5O5 азотный ангидрид
Физические свойства
Кристаллическое вещество, летучее, неустойчивое.
Получение
1. 2NO2 + O3 ® N2O5 + O2
2. 2HNO3 +P2O5 ® 2HPO3 + N2O5
Химические свойства
1. Кислотный оксид N2O5 + H2O ® 2HNO3
2. Сильный окислитель
3. Легко разлагается (при нагревании - со взрывом):
| 2N2O5 ® 4NO2 + O2 |
АЗОТИСТАЯ КИСЛОТА HNO2 Азотистая кислота
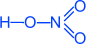
H–O–N=O
Физические свойства
Существует только в разбавленных водных растворах.
Получение
AgNO2 + HCl ® HNO2 + AgCl¯
Химические свойства
1. Слабая кислота; ее соли (нитриты) – устойчивы:
HNO2 + NaOH ® NaNO2 + H2O
2. Разлагается при нагревании:
3HNO2 ® HNO3 + 2NO + H2O
3. Слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями)
2KNO2 + 2KI + 2H2SO4 ® 2K2SO4 + I2 + 2NO + 2H2O
| 2I- - 2ē ® I20 | |
| NO2- + 2H+ + 1ē ® NO + H2O |
2I- + 2NO2- + 4H+ ® I20 + 2NO + 2H2O
4. Сильный восстановитель:
HNO2 + Cl2 + H2O ® HNO3 + 2HCl
АЗОТНАЯ КИСЛОТА
HNO3 Азотная кислота
Физические свойства
Бесцветная жидкость, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3
Date: 2015-08-07; view: 687; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |