
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Непрямое окислительное дезаминирование (трансдезаминирование)
Включает в себя 2 этапа и активно идет во всех клетках организма.
Ø Первый этап.
Трансаминирование - реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и новая аминокислота
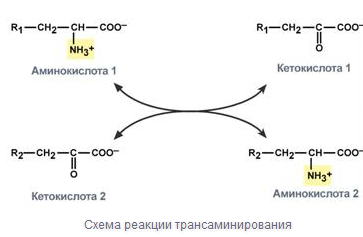
В результате трансаминирования свободные аминокислоты теряют NH2- группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в ЦТК и тканевой дыхание, где сгорает до СО2 и Н2О. При необходимости (стресс, голод) углеродные кетоскелет может использоваться для синтеза глюкозы в глюконеогенезе.
Эту реакцию катализируют ферменты под названием трансаминазы (аминотрансферазы).
Коферментом всех трансаминаз является активная форма витамина В6 - пиридоксальфосфат (фосфопиридоксаль).
Ø Второй этап состоит в отщепление аминогруппы от «аминокислоты-2» - дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется НАД зависимой- глуматдегидрогеназой.
В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислот, и только она подвергается окислительному дезаминированию с образованием аммиака и а-кетоглутаровой кислоты.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминированием.
Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 разных аминотрансфераз.
АЛТ – аланинаминотрасфераза (АлАТ) катализирует реакцию трансаминирования между аланином и α-кетоглутаратом. Локализован этот фермент в цитоплазме клеток многих органов, но наибольшее его количество обнаружено в клетках печени.
ACT - аспартатаминотрансфераза (АсАТ) катализирует реакцию трансаминирования между аспартамом и α-кетоглутаратом. В результате образуются оксалоацетат и глутамат. ACT имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее его количество обнаружено в клетках сердечной мышцы.
Так как наибольшее количество АЛТ и ACT сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов.
Следует отметить, что эти ферменты являются внутриклеточными. То есть, они преимущественно локализованы в клетке, а не в крови. При определенных патологиях количество ферментов может увеличиваться в крови, что будет свидетельствовать о нарушении целостности клеток.
Существует коэффициент де Ритиса у здоровых лиц АСТ/АЛТ в плазме крови = 1,33±0,42 или 0,91-1,75; при инфаркте резко возрастает, при гепатитах понижается до 0,6.
Биологическое значение трансдезаминировония:
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот.
Трансаминирование - заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется.
Коллекторная функция а-кетоглутаровой кислоты для групп –NH2 от аминокислот и передача их в цикл биосинтеза мочевины.
КЕТОГЕННЫЕ АМИНОКИСЛОТЫ: лейцин, лизин, триптофан). Они могут прямо трансформироваться в жирные кислоты или в кетоновые тела.
5. Судьба аммиака в организме. Механизмы токсичности аммиака. Роль дикарбоновых аминокислот в транспорте и превращении аммиака в организме. Пути обезвреживания аммиака в организме: образование аммонийных солей, восстановительное аминирование а-кетокислот в организме, образование амидов дикарбоновых кислот, синтез мочевины.
Образующийся при дезаминировании аминокислот аммиак токсичен и должен быть выведен из организма.
В крови концентрация аммиака не превышает 0,02-0,04 ммоль/л
Раздражение ЦНС при концентрации выше 0,0 ммоль/л приводят к рвоте, судорогам, потери сознания и в конечном итоге смерти.
Аммиак способствует алкалозу (смещение рН крови в щелочную сторону), связывая протоны водорода.
Способствует восстановительному минированию а-кетокислот; из-за снижения –кетокислот тормозятся реакции трансаминирования, ЦТК, подавление дыхания, образования АТФ, что приводит к усиленю синтеза кетоновых тел из ацетил-КоА в печени.
Стимулирует синтез глутамина в нервной ткани (отек ЦНС) и снижается образование ГАМК.
Как же организма справляется с аммиаком?
Механизмы обезвреживания аммиака:
1. Образование аммонийных солей NH4Cl, (NH4)2 (0,5 г/сут), которые выводятся из организма с мочой. при ацидозе из образование усиливается, что сберегает для организма катиона Na+, К+;
2. Восстановительное аминирование (реаминирование) и трансаминирования а-кетокислот – является механизмом обезвреживания аммиака и одновременно вариантом биосинтеза заменимых аминокислот из а-кетокислот, которые могут быть образованы при окислении глюкозы.
Вид аминирования при котором карбонильная группа замещается на амин через промежуточный имин.
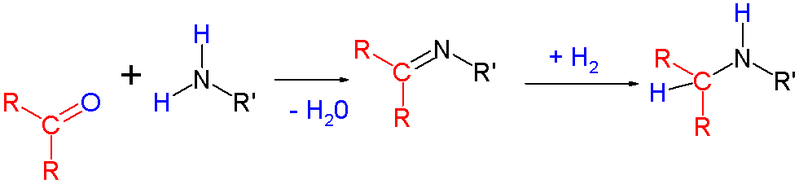
3. Образование амидов дикарбоновых кислот – важный путь обезвреживания аммиака в тканях мозга, скелетных мышц и печени, откуда он (в составе глутамина и аспарагина) поступает в кровь, а затем в печень и почки, где превращаются в мочевину и соли аммония, которые удаляются с мочой. Ферментами служат глутаминсинтетаза и глутаминаза.
4. Биосинтез мочевины (NH2-CO-NH2):
- это циклический процесс, в котором важную роль выполняют орнитин-цитруллин и аргинин.
- механизмы биосинтеза карбамоилфосфата; Фермент- карбамоиофосфатсинетаза-I.
6. Синтез мочевины. Источники азота в молекуле мочевины. Энергетические затраты на образование молекулы мочевины. Связь орнитинового цикла и ЦТК. Причины возникновения гипераммониемий, роль печени и почек в механизме обезвреживания аммиака. Диагностическое значение и принцип метода определения мочевины в сыворотке крови.
Катаболизм аминокислот в тканях происходит постоянно со скоростью ∼100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака. Аммиак является ядом прежде всего для ЦНС, поэтому в организме человека он превращается в хорошо растворимое нетоксичное соединение – мочевину.
Синтез мочевины.
В печени весь удаляемые аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодании, воспалительные процессы, сахарный диабет) или при избыточном белковом питании.
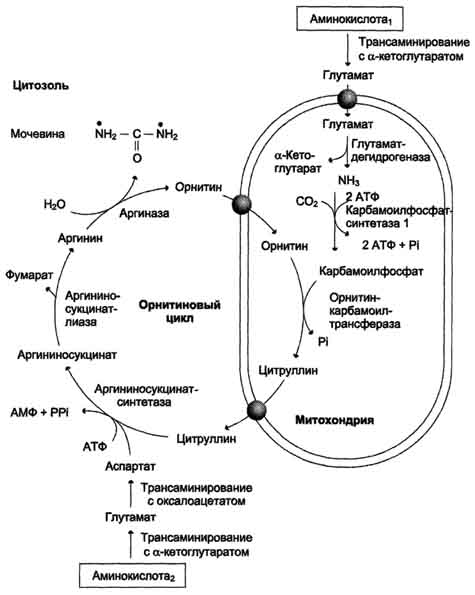
Реакция синтеза мочевины является циклическим процессом и получил названия
орнитиновый цикл. Синтез мочевины начинается в митохондриях (первая и вторая реакция), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики.
Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из неё образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином.
Реакции синтеза мочевины.
Мочевина (карбамид) – полный амид угольной кислоты – содержит 2 атома азота. Источником одного из них является аммиак, который в печени связывается с СО2 с образованием карбомоилфосфата под действием карбомоилфосфатрансферазы I.
Далее под действием орнитинкарбомоилтрансферазы карбомоильная группа карбомоилфосфата переносится на а-аминокислоту оринтин, и образуется другая а-аминокислота – цитруллин.
В следующей реакции аргининсукцинатсинтетаза связывает цитруллин с аспартатом и образуется аргининсукцинат. Этот фермент нуждается в ионах Мg+2. В реакции затрачивается 1 моль АТФ, но используется энергия двух макроэргических связей. Аспартат – источник второго атома азота мочевины.
Далее фермент аргининсукцинатлиаза расщепляет аргининсукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина.
Аргинин подвергается гидролизу под действием аргиназы, при этом образуется орнитин и мочевина.
Образующийся орнитин снова взаимодействует с новой молекулой карбомоилфосфата, и цикл замыкается.
Первые две реакции осуществляется в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения.
Энергетический баланс процесса.
В реакциях орнитинового цикла расходуются четыре макроэргических связей трёх молекул. Однако имеются пути компенсации энергозатрат:
· При включении фумарата в ЦТК на стадии дегидрировании малата образуется НАДФН2, который обеспечивает синтез 3 молекул АТФ (в дыхательной цепи).
· При окислительном дезаминировании глутамат в разных органах также образуется НАДН2 – соответственно мы получаем еще 3 молекулы АТФ.
Гипераммониемия.
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови - гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови - гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла.
В литературе описаны случаи всех этих довольно редких энзимопатий, среди которых отмечено больше всего случаев гипераммониемии II типа.
Нарушение орнитинового цикла наблюдается при гепатитах различной этиологии и некоторых других вирусных заболеваниях. Например, установлено, что вирусы гриппа и других острых респираторных вирусных инфекций снижают активность карбамоилфосфатсинтетазы I. При циррозе и других заболеваниях печени также часто наблюдают гипераммониемию.
Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников. Так, при дефекте аргининосукцинатсинтетазы повышается содержание цитруллина (цитруллинемия); при дефекте аргиназы - концентрация аргинина, аргининосукцината, цитруллина и т.д. При гипераммониемиях I и II типа вследствие дефекта орнитинкарбамоилтрансферазы происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой. Содержание всех метаболитов повышается, и состояние больных ухудшается при увеличении количества белков в пище. Тяжесть течения заболевания зависит также от степени снижения активности ферментов.
Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина.
Гипераммониемия сопровождается появлением следующих симптомов:
- тошнота, повторяющаяся рвота;
- головокружение, судороги;
- потеря сознания, отёк мозга (в тяжёлых случаях);
- отставание умственного развития (при хронической врождённой форме).
| Заболевание | Дефект фермента | Тип наследования | Клинические проявления | Метаболиты | |
| кровь | моча | ||||
| Гиперам- мониемия, тип I | Карбамоил- фосфат- синтетаза I | Аутосомно- рецессивный | В течение 24-48 ч после рождения кома, смерть | Глн Ала NH3 | Оротат |
| Гиперам- мониемия, тип II | Орнитин- карбамоил- трансфераза | Сцепленный с Х-хромосомой | Гипотония, снижение толерантности к белкам | Глн Ала NH3 | Оротат |
| Цитрул- линемия | Аргинино- сукцинат- синтетаза | Аутосомно- рецессивный | Гипераммониемия тяжёлая у новорождённых. У взрослых - после белковой нагрузки | Цитруллин NH3 | Цитруллин |
| Аргинино- сукцина- турия | Аргинино- сукцинат- лиаза | Аутосомно-рецессивный | Гипераммонимия, атаксия, судороги, выпадение волос | Аргини-носукцинат NH3 | Аргини- носукци- нат, Глн, Ала, Лиз |
| Гиперар- гининемия | Аргиназа | Аутосомно-рецессивный | Гипераргининемия | Apr NH3 | Apr Лиз Орнитин |
Основной диагностический признак -повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме - 60 мкмоль/л). Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложнённых заболеваний.
Определение мочевины в сыворотке крови смотри в протоколе.
7. Биосинтез заменимых аминокислот: схема превращения и регуляция.
Date: 2015-08-06; view: 2965; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |