
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ. При составлении уравнений ОВР нужно учесть, что число электронов, отданных восстановителем, равно числу электронов
При составлении уравнений ОВР нужно учесть, что число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
В химии условный заряд электрона принят за «-1» и обозначается 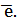 Для подбора стехиометрических коэффициентов можно использовать несколько методов, из которых наиболее распространены два: метод электронного баланса и метод электронно-ионных уравнений (метод полуреакций).
Для подбора стехиометрических коэффициентов можно использовать несколько методов, из которых наиболее распространены два: метод электронного баланса и метод электронно-ионных уравнений (метод полуреакций).
1. Метод электронного баланса является наиболее универсальным методом, и применим для любых окислительно-восстановительных процессов, протекающих в любых системах (растворы, расплавы, газы). В основе метода лежит принцип сравнения степеней окисления атомов в исходных веществах и в продуктах реакции с последующим составлением схемы электронного баланса.
В качестве примера рассмотрим реакцию взаимодействия дихромата калия с сероводородом в кислой среде:
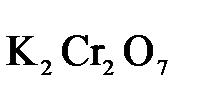 +
+ 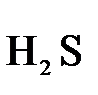 +
+ 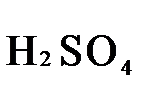 →
→ 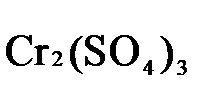 +
+ 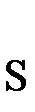 +
+ 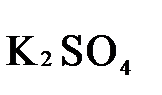 +
+ 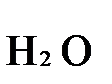
Для расстановки коэффициентов выполняем следующие действия.
1.1. Определяем элементы, атомы которых изменяют степень окисления:
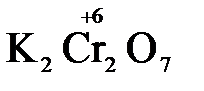 +
+  +
+ 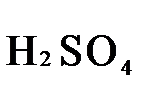 →
→ 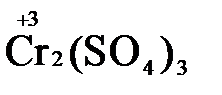 +
+ 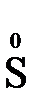 +
+ 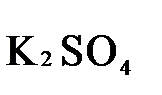 +
+ 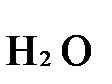
1.2. Находим окислитель и восстановитель в данной ОВР, составляем схему перехода электронов от восстановителя к окислителю и пишем отдельно электронные уравнения процессов окисления и восстановления, с учетом того, что количество атомов, входящих в соединение, должно сохраняться. Например, в 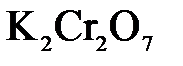 имеется два атома Cr, следовательно, в схеме они должны присутствовать:
имеется два атома Cr, следовательно, в схеме они должны присутствовать:
+5ē
-2ē
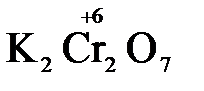 +
+  +
+ 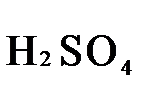 →
→ 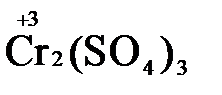 +
+ 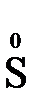 +
+ 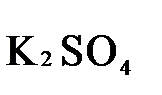 +
+ 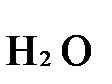
окислитель восстановитель
2Cr+6 + 6 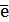 = 2Cr+3 (а) - восстановление
= 2Cr+3 (а) - восстановление
S-2 - 2 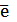 = S0 (б) - окисление
= S0 (б) - окисление
1.3. Уравниваем число электронов в процессе окисления и восстановления (электронный баланс). В приведенной схеме необходимо уравнение (б) умножить на 3, тогда будет принято и отдано по 6 электронов. После умножения уравнения складываются как обычные алгебраические, а электроны сокращаются.
2Cr+6 + 6 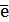 = 2Cr+3 1
= 2Cr+3 1
+
S-2 - 2 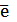 = S0 3
= S0 3
2Cr+6 +3S-2 = 2Cr+3 + 3 S0
1.4. Полученные коэффициенты называют основными. Они переносятся в молекулярную схему реакции и ставятся перед соответствующими веществами. Так как в молекулах дихромата калия и сульфата хрома содержится по два атома хрома, двойки перед этими веществами опускаются.
K2Cr2O7 + 3H2S + H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + H2O
1.5. Окончательно уравниваем число атомов каждого элемента в обеих частях молекулярного уравнения. Продукты реакции (Cr2(SO4)3, K2SO4),
имеющие коэффициенты по единице, содержат 4 моль сульфат-ионов (SO42-), которые содержатся в серной кислоте, следовательно, перед ней ставится коэффициент 4. Чтобы количество атомов водорода было одинаково в левой и правой части уравнения, перед водой ставится коэффициент 7:
K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + 7H2O
Проверка количества остальных атомов показывает, что все коэффициенты подобраны.
2. Метод электронно-ионных уравнений (метод полуреакций) применяется для подбора коэффициентов в уравнениях реакций, протекающих в растворах. Метод оперирует с реально существующими в растворах частицами и позволяет учитывать влияние среды раствора (т.е. рН) на процессы окисления и восстановления частиц. В качестве частиц среды в водных растворах могут принимать участие следующие частицы.
Таблица 1
| Кислотность (рН) | Исходные частицы | Продукты |
| Кислая среда (рН<7) | Н+ и Н2О | Н2О и ОН- |
| Нейтральная среда (рН = 7) | Н2О | Н+ и ОН- |
| Щелочная среда (рН>7) | Н2О и ОН- | Н2О и ОН- |
В качестве примера рассмотрим ту же реакцию.
2.1. Молекулярная схема реакции:
K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + S + K2SO4 + H2O
2.2. Записываем это уравнение в ионно-молекулярной форме. Для этого необходимо все сильные электролиты представить в виде ионов, а слабые электролиты, газы и малорастворимые вещества оставляем в виде молекул. К сильным электролитам относятся все хорошо растворимые соли, часть кислот (HCl, HNO3, H2SO4 и др.), щелочи (LiOH, NaOH, KOH и др.). Степень окисления атомов не используют, а учитывают заряды реальных ионов и характер среды, в которой идет окислительно-восстановительный процесс.
2K+ + Cr2O7-2 + H2S + 2 H+ + SO4-2 = 2Cr+3+3SO4-2 + S0 + 2K+ +SO4-2 + H2O
кислая среда
2.3. Определяем частицы, изменившие свой заряд или состав:
Cr2O7-2 → 2Cr+3 и H2S → S0
2.4. На основании этих превращений составляем полуреакции окисления и восстановления с участием частиц среды (см. табл.1). Анион дихромата потерял 7 моль атомов кислорода, которые в кислой среде связываются 14 моль ионами водорода и превращаются в воду. Молекула сероводорода потеряла 2 моль ионов водорода.
Cr2O7-2 + 14Н+ → 2Cr+3 + 7Н2О
H2S → S0 + 2Н+
2.5. Полученные полуреакции необходимо уравнять по зарядам. В первом уравнении слева суммарный заряд равен (+12), а справа – (+6), значит, дихромат-ион присоединил 6 электронов и восстанавливается. Во втором уравнении слева (0), а справа – (+2). Молекула сероводорода потеряла 2 электрона и окислилась.
Cr2O7-2 + 14Н+ +6 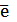 → 2Cr+3 + 7Н2О
→ 2Cr+3 + 7Н2О
H2S - 2 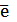 → S0 + 2Н+
→ S0 + 2Н+
2.6. Для соблюдения электронного баланса второе уравнение необходимо умножить на 3, после чего просуммировать уравнения.
Cr2O7-2 + 14Н+ +6 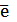 → 2Cr+3 + 7Н2О 1
→ 2Cr+3 + 7Н2О 1
+
H2S - 2 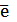 → S0 + 2Н+ 3
→ S0 + 2Н+ 3
Cr2O7-2 + 14Н+ + 3H2S = 2Cr+3 + 7Н2О + 3S0 + 6Н+
После сокращения подобных частиц в левой и правой частях уравнения получим суммарное ионно-молекулярное уравнение, которое отражает смысл произошедшей реакции.
Cr2O7-2 + 8Н+ + 3H2S = 2Cr+3 + 7Н2О + 3S0
Перенос полученных коэффициентов в молекулярную схему реакции позволяет получить ее полное уравнение:
K2Cr2O7 + 3H2S + 4H2SO4 = Cr2(SO4)3 + 3S + K2SO4 + 7H2O
Иногда в реакции окислитель является одновременно и средой. Например, в реакции:
I2 + HNO3® HIO3 +NO2 +H2O
азотная кислота HNO3 одновременно содержит окислитель ион NO3- и создает кислую среду (наличие ионов Н+).
Представим молекулярное уравнение в ионно-молекулярном виде:
I2 + H+ + NO3-® IO3- +NO2 +H2O
Далее составим полуреакции окисления и восстановления с участием частиц среды (см.табл.1) и для соблюдения электронного баланса умножим первое уравнение на 10, а затем полуреакции просуммируем:
NO3- + 2H+ +ē®NO2 +H2O 10
I2 + 6H2O - 10ē ® 2IO3- + 12H+
10NO3- + 20 H+ + I2 + 6H2O®10NO2 +10 H2O + 2 IO3- + 12H+
После сокращения подобных частиц в левой и правой частях уравнения получим суммарное ионно-молекулярное уравнение:
10NO3- + 8 H+ + I2 ®10NO2 +4 H2O + 2 IO3-
Затем полученные коэффициенты перенесем в молекулярную схему реакции. Учитывая, что ионы NO3- и H+ входят в состав одного и того же соединения, а количество их разное, перед HNO3 ставится максимальный коэффициент, так как. часть азотной кислоты расходуется на создание кислой среды. Таким образом, полное уравнение:
I2 + 10HNO3®2HIO3 +10NO2 +4H2O
Метод полуреакций позволяет определить коэффициенты перед всеми веществами, участвующими в реакции, что значительно упрощает подбор дополнительных коэффициентов.
Date: 2015-07-27; view: 412; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |