
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

ВВЕДЕНИЕ. Цель работы: изучение спектра водорода, экспериментальное определение длин волн линий в этом спектре и сопоставление полученных на опыте значений с теорией
СПЕКТР АТОМА ВОДОРОДА
Цель работы: изучение спектра водорода, экспериментальное определение длин волн линий в этом спектре и сопоставление полученных на опыте значений с теорией.
Вопросы, знание которых обязательно
для допуска к выполнению работы:
1. Что такое спектры испускания и поглощения?
2. Виды спектров.
3. Чем отличается сплошной спектр от линейчатого?
4. Что называется дисперсией света? Какова причина этого явления?
5. Какие лучи видимого спектра (красные или фиолетовые) имеют большую скорость в стекле?
6. Классические модели атома.
7. Сериальная формула Бальмера-Ридберга.
8. Постулаты Бора.
9. Какие приборы называются спектральными?
10. Устройство монохроматора.
ВВЕДЕНИЕ
Свет, благодаря которому мы зрительно воспринимаем окружающий мир, имеет сложный по длинам волн состав. Этот состав определяется природой вещества, которое его испускает, и его состоянием, например, температурой. О степени сложности света можно судить на основании наблюдения его спектра. Спектры принято подразделять на линейчатые, полосатые и сплошные.
Линейчатые спектры получаются при исследовании света, испускаемого отдельными атомами и ионами газов и раскаленных паров. Эти спектры состоят из определенного числа тонких ярких линий при свечении газов или паров в электрической дуге или разряде (спектры испускания) и в виде тёмных линий (спектров поглощения).
Линейчатые спектры возникают при переходах между уровнями энергии внешних электронов атома и наблюдаются в видимой, ультрафиолетовой и инфракрасной областях. Такими спектрами обладают как нейтральные, так и ионизованные атомы; их часто называют соответственно дуговыми и искровыми спектрами (нейтральные атомы легко возбуждаются и дают спектры испускания в электрических дугах, а положительные ионы возбуждаются труднее и дают спектры испускания преимущественно в искровых электрических разрядах). Спектры ионизованных атомов смещены по отношению к спектрам нейтральных атомов в область больших частот, т. е. в ультрафиолетовую область. Это смещение тем больше, чем выше кратность ионизации атома — чем больше электронов он потерял.
В реально наблюдаемых спектрах часто присутствуют одновременно линии нейтрального и ионизованных атомов.
Линии спектров образуют закономерные группы, называются спектральными сериями. Промежутки между линиями в серии убывают в сторону коротких длин волн, и линии сходятся к границе серии (рис. 1).
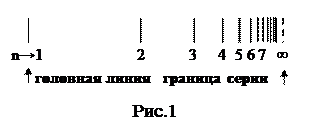 Закономерности в распределении спектральных линий в линейчатых спектрах сыграли большую роль в создании теории строения атома. По положениям линий в спектре можно судить о составе газа. На этом основан спектральный анализ.
Закономерности в распределении спектральных линий в линейчатых спектрах сыграли большую роль в создании теории строения атома. По положениям линий в спектре можно судить о составе газа. На этом основан спектральный анализ.
Для простейшего объекта исследования – атома водорода – было установлено, что частоты наблюдаемых линий в спектре описываются так называемой сериальной формулой Бальмера-Ридберга:
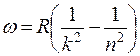 , (1)
, (1)
где k = 1, 2, 3,… - номер серии, а n=k+1, k+2, …– целое число, определяющее линии в пределах серии; 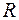 = 2,07∙1016 рад/с – постоянная Ридберга.
= 2,07∙1016 рад/с – постоянная Ридберга.
При k=1 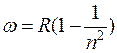 – серия Лаймана
– серия Лаймана
(ультрафиолетовая n=2,3,4, область спектра);
при k=2 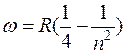 – серия Бальмера
– серия Бальмера
(видимая n=3,4,5, область спектра);
при k=3 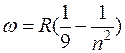 – серия Пашена
– серия Пашена
(инфракрасная n=4,5,6, область спектра);
при k=4 и 5, соответственно, серии Брэкета и Пфунда (рис.2).
 При возрастании n в пределах одной серии частота стремится к предельному значению
При возрастании n в пределах одной серии частота стремится к предельному значению 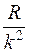 , которое называется границей серии (рис. 1).
, которое называется границей серии (рис. 1).
Очевидно, что в дискретной структуре атомных спектров проявляются квантовые закономерности. Энергия излучаемых квантов составляет:
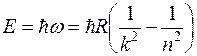 (2)
(2)
Наибольшая частота соответствует n=∞, что соответствует энергии ионизации атома. При ионизации атома водорода затрачивается энергия 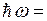 13.6 эВ. Поэтому энергию квантов серии можно найти следующим образом
13.6 эВ. Поэтому энергию квантов серии можно найти следующим образом
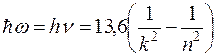 (3)
(3)
Аналогичными спектрами, только с увеличенным в Z2 раз масштабом (Z — атомный номер), обладают водородоподобные ионы Не+, Li2+.
Классическая теория не могла объяснить ни устойчивость атома, ни характер атомного спектра. Выход из создавшегося тупика был найден в 1913 г. датским ученым Нильсом Бором, который постулировал дискретность энергетических состояний атомов, откуда с необходимостью следует квантовый характер поглощения и излучения света.
Первый постулат Бора гласит: атом может находиться лишь в определенных дискретных энергетических состояниях, в которых он не излучает, несмотря на ускоренные движения входящих в его состав заряженных частиц. Такие состояния называются стационарными.
Согласно второму постулату атом излучает или поглощает энергию лишь при скачкообразном переходе из одного стационарного состояния в другое. При этом частота излученного или поглощенного кванта света пропорциональна разности энергии начального Еm и конечного En состояний:
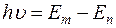 , (4)
, (4)
где h – постоянная Планка; ν – частота света; m – уровень с которого переходит электрон; n – уровень на который переходит электрон.
Постулаты Бора имеют чрезвычайно общий характер и применимы к любому атому или атомной системе. Их правильность многократно подтверждена экспериментально, следовательно, теория Бора хорошо описывает физический механизм поглощения и излучения света.
Таким образом, каждая линия соответствует определенному переходу на энергетической диаграмме (рис. 2). Изменение энергии при переходе 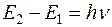 , где частота v может быть пересчитана на длину волны:
, где частота v может быть пересчитана на длину волны:
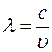 (5)
(5)
Молекулярные спектры при наблюдении их в прибор средней разрешающей способности представляются состоящими из полос – полосатый спектр.
При более тщательном изучении спектров с помощью приборов высокой разрешающей силы выяснилось, что каждая полоса, в свою очередь, состоит из большого числа близко расположенных линий. Эта особенность молекулярных спектров объясняется наличием различных компонент в энергии молекул.
Сплошной спектр имеет свет, испускаемый раскаленными конденсированными системами – жидкостями и твердыми телами. Такой спектр представляет собой непрерывную полосу, содержащую все части видимого света от красного до фиолетового а также инфракрасное и ультрафиолетовое излучения, то есть свет всевозможных длин волн.
Спектры поглощения получаются, если пучок света, испускаемый каким-либо раскаленным телом, пропускать через газообразную среду, спектр которой нужно исследовать. По своему виду спектр поглощения отличается от сплошного тем, что в нем на фоне сплошного спектра имеются темные линии или области. Закон Кирхгофа устанавливает, что любое тело поглощает только те лучи, которые оно само может испускать. Следовательно, если светящиеся пары натрия, например, испускают две цветные линии в желтой части спектра, то при пропускании через пары натрия "белого" света именно эти лучи будут поглощены. В спектре поглощения получаются две темные линии в том самом месте, где находились бы желтые линии спектра испускания паров натрия.
Приборы, предназначенные для исследования спектров, образованных прииспускании света различными физическими телами - звездами, раскаленными парами металлов, газами при электрическом разряде и т.п., называют спектральными приборами.
Описание установки.
Исследование спектра излучения водорода в данной работе производится с помощью монохроматора УМ-2. Монохроматор выделяет монохроматические участки спектра в видимой и инфракрасной областях в диапазоне длин волн от 380 до 1000 нм (1 мкм = 10-6м, 1 нм = 10-9м). Если на входную щель направить сложный свет, то на выходе получается спектр. В монохроматоре на выходе ставят еще одну щель, которая выделяет из спектра только лучи определенной длины волны. Но в данной работе выходная щель удалена и с помощью окуляра можно наблюдать спектр (или отдельные его части), т.е. монохроматор используется как спектроскоп.
 В работе используется стеклянно-призменный монохроматор УМ-2, предназначенный для спектральных исследований в диапазоне от 3800 до 10000 Å. В состав прибора входят следующие основные части (рис. 3).
В работе используется стеклянно-призменный монохроматор УМ-2, предназначенный для спектральных исследований в диапазоне от 3800 до 10000 Å. В состав прибора входят следующие основные части (рис. 3).
|
Задания и указания к их выполнению
Задание 1. Ознакомиться с устройством монохроматора. Выяснить назначение ручек управления.
Задание 2. Перейдите непосредственно к измерениям.
· Проградуируйте деления барабана монохроматора в значениях длин волн. Используйте для этого известный спектр ртути.
· Для этого, осветите входную щель спектроскопа светом от ртутной лампы (включать только под наблюдением лаборанта!). Сделайте щель узкой и пронаблюдайте в окуляр спектр. Линии должны быть яркими и узкими.
· Занесите в таблицу 1 значения делений барабана для наблюдаемых линий и укажите цвет каждой линии. Следует иметь в виду, что установка указателя на барабане может сбиваться (указатель может соскочить на соседнюю дорожку).
Таблица 1
| № | Цвет линии | Длина волны l, нм | Показания шкалы барабана L, град. |
| 1. | Темно красная слабая | 623.43 | |
| 2. | Светло желтые: 1 - ая 2 - ая | 579.06 576.96 | |
| 3. | Зеленая | 546.07 | |
| 4. | Зелено - голубые: 1 - ая 2 - ая | 496.03 491.60 | |
| 5. | Синяя | 435.83 | |
| 6. | Фиолетовые: 1 - ая 2 - ая | 407.78 404.65 |
· Постройте по спектру ртути градуировочную кривую, отложив по горизонтали деления барабана, а по вертикали – значения длин волн.
Задание 3. Поставьте теперь в качестве источника света трубку с водородом ТВС-15, через которую пропускается ток от питающего устройства ОУ-2.
· Занесите в таблицу 2 значения делений барабана для наиболее ярких линий водорода.
· Пользуясь градуировочной кривой, переведите эти значения в длины волн. Сравните экспериментальные данные с рассчитанными по формуле (5), т.е. с теоретическими значениями. Объясните возможные причины погрешностей экспериментальных данных.
· Укажите, каким переходам на энергетической диаграмме на рисунке 2 соответствуют наблюдаемые вами линии.
Таблица 2
| № | Цвет линии | Показания шкалы барабана L¢, град. | Длина волны l¢, нм | Длина волны, рассчитанная по формуле (5), нм |
| 1. | ||||
| 2. | ||||
| 3. | ||||
| 4. |
Контрольная карточка № 1.
1. Перечислите серии спектра водорода. Какому переходу соответствует головная линия в каждой серии?
2. 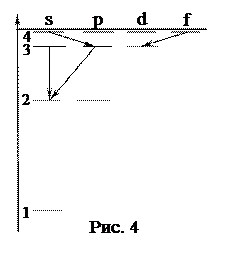 Оценить скорость движения электрона в атоме согласно модели Бора.
Оценить скорость движения электрона в атоме согласно модели Бора.
3. В энергетическом спектре атома водорода (рис. 4) какой переход является запрещенным?
4. Атом водорода излучил квант света с длиной волны λ = 6,65 10-7 м. Во сколько раз изменился при этом радиус электронной орбиты?
5. Вычислить энергию фотона ε, испускаемого при переходе электрона в атоме водорода с третьего уровня на первый.
Контрольная карточка № 2
1. Запишите формулу Бора для каждой серии спектра водорода.
2. В каком диапазоне электромагнитных волн находятся линии серии Бальмера?
3. Электрон в атоме водорода перешел из основного состояния в возбужденное, получив энергию Е =12,8 эВ. Какую наибольшую длину волны может теперь излучить атом водорода?
4. Определить наибольшую и наименьшую энергию фотонов в серии Лаймана спектра водорода.
5. Найти радиусы трех первых боровских электронных орбит в атоме водорода и скорости электрона на них.
Контрольная карточка № 3
1. Определить длину волны λ, соответствующую третьей спектральной линии в серии Бальмера.
2. Найти наибольшую λmax и наименьшую λmin длины волн в первой инфракрасной серии спектра водорода (серии Пашена).
3. Вычислить радиусы второй и третьей орбит в атоме водорода.
4. Определить частоту обращения электрона на второй орбите атома водорода.
5. Найти наибольшую длину волны в ультрафиолетовой области спектра водорода. Какую наименьшую скорость должны иметь электроны, чтобы при возбуждении атомов водорода ударами электронов появилась эта линия?
Контрольная карточка № 4
1. Оценить длину волны де-Бройля для электрона на каком-либо конкретном уровне, сравнить ее с радиусом орбиты. Объяснить полученный результат.
2. В каком диапазоне может лежать излучение положительного атомарного иона водорода?
3. Определить скорость электрона на второй орбите атома водорода.
4. Определить угловую скорость электрона на первой боровской орбите атома водорода.
5. Найти кинетическую, потенциальную и полную энергии электрона на первой боровской орбите.
Date: 2015-08-06; view: 906; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |