
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Квазистатические, обратимые и необратимые термодинамические процессы
Пусть в начальный момент система находилась в термодинамическом равновесии с внешней средой (или была изолирована). Если изменить параметры внешней среды (или осуществить какое-либо воздействие), то в результате релаксации в этой системе установится новое равновесное состояние. В случае слабого изменения внешних условий (слабого воздействия) начальное и конечное состояния системы мало различаются.
Осуществляя большое число малых воздействий, можно перевести систему в некоторое конечное состояние, значительно отличающееся от начального. Совокупность всех промежуточных состояний называют траекторией процесса.
Если по ходу процесса рассматриваемая система в каждый момент находится вблизи некоторого состояния термодинамического равновесия, отвечающего суммарному результату произведенного на нее воздействия, то такой процесс называется квазистатическим или равновесным. Поскольку равновесное состояние системы характеризуется небольшим числом параметров, то описание равновесного процесса сводится к установлению закона изменения тех же параметров.
Для равновесного процесса скорость изменения макроскопического параметра х должна удовлетворять условию тау |dx/dt| << |Дельта х|, где тау — время релаксации, Дельта х — характерный масштаб изменения величины х.
Если на траектории встречаются неравновесные состояния, то процесс называется неравновесным.
Обратимые и необратимые процессы. Процесс называется обратимым, если он может быть проведен в обратном направлении через те же промежуточные состояния, что и прямой процесс, причем во всех остальных телах никаких изменений произойти не должно. Если же это осуществить невозможно, то процесс называется необратимым.
Равновесный процесс всегда обратим. Обратимость следует из того, что любое промежуточное состояние есть состояние термодинамического равновесия, а оно не зависит от того, идет процесс в прямом или обратном направлении.
Необратимые процессы возникают благодаря трению, теплообмену при наличии конечных скачков температуры и давления, за счет процессов диффузии и т. д. Примеры необратимых процессов: вытекание газа из сосуда в вакуум, нагрев холодного тела при его контакте с горячим и т. д.
Стандартная версия | Мобильная версия
© 2010-2014 mipt1.ru Операция "Раздолбай"------------------------------------------------------------------------------------------------------------------------
| ||||||||||||
В настоящее время в науке сложилось два способа описания процессов, происходящих в макроскопических телах:статистический и термодинамический.
Макроскопические тела –это тела, состоящие из очень большого числа частиц (атомов или молекул). Поведение большой совокупности частиц отличается от поведения каждой частицы в отдельности.
Статистической физикойназывается раздел физики, посвященный изучению свойств макроскопических тел, исходя из свойств образующих тело частиц и взаимодействия между ними.
В огромной совокупности частиц (молекул) возникают качественно новые закономерности - статистические. Статистическая физика изучает статистические закономерности и пользуется вероятностными методами.
В статистической физике пользуются статистическим методом, который позволяет определить не поведение отдельных частиц, а только средние величины, характеризующие движение и взаимодействие огромной совокупности частиц (молекул).
Термодинамический способ описания процессов изучает свойства макроскопических тел, не вдаваясь в микроскопическую природу тел. Раздел физики, использующий термодинамический метод описания процессов называют термодинамикой.
В основе термодинамики лежит небольшое число фундаментальных законов, установленных путем обобщения очень большого количества опытных фактов. Статистическая физика и термодинамика подходя с разных точек зрения к рассмотрению изменения состояния вещества, взаимно дополняют друг друга, и образуют единое целое.
Термодинамической системой называется совокупность макроскопических тел, взаимодействующих и обменивающихся энергией как между собой так и с другими (внешними) телами. Состояние термодинамической системы характеризуется величинами, называемыми термодинамическими параметрами состояния (параметрами состояния).
Параметры состояния– совокупность физических величин, характеризующих свойства термодинамической системы.
Обычно в качестве параметров состояния применяют: температуру (Т), давление (р), объём (V), массу газа (m), молярную массу газа – (Μ), внутреннюю энергию – U, энтропию – S и т.д.
Температура – это физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. В настоящее время в нашей стране используют только две температурные шкалы –термодинамическую и Международную практическую, градуированные соответственно в кельвинах (К) и в градусах Цельсия (оС).
В Международной практической шкале температура замерзания и кипения воды при давлении 1,013·105 Па соответственно равны 0 и 100оС (так называемые реперные точки).
Между термодинамической температурой и температурой по шкале Цельсия связь задана соотношением:
Температура Т = 0 К называется нулём кельвин. Анализ процессов показывает, что 0 К недостижим, хотя приближение к нему сколь угодно близко возможно. Параметры состояния системы могут изменяться. Математическая связь между параметрами газа называется уравнением состояния и в общем виде записывается соотношением:
Для дальнейших расчётов нам будут нужны: газовая постоянная – R и постоянной Больцмана – k. В 1875 годурусский учёный Д.И. Менделеев объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение к одному молю и ввел общую для всех газов постоянную, которая обозначается R и называется молярной газовой постоянной или газовой постоянной. Молярная газовая постоянная равна:
Молярная газовая постоянная численно равна работе изобарного расширения, которую нужно совершить одному молю газа, при нагревании его на один кельвин. «Доля» газовой постоянной, приходящейся на одну молекулу называется постоянной Больцмана:
Постоянная Больцмана обозначается буквой k, она равна:
Важной характеристикой термодинамической системы является ее внутренняя энергия – U. Внутренняя энергия слагается из кинетической энергии поступательного движения молекул, кинетической и потенциальной энергий колебательного движения атомов в молекулах, потенциальной энергии взаимодействия между молекулами и внутримолекулярной энергии (т.е. энергии электронных оболочек атомов и внутри ядерной). Энергия взаимодействия много меньше энергии системы тел, и ею можно пренебречь. Кинетическая энергия тела как целого и его потенциальная энергия во внешнем силовом поле во внутреннюю энергию не входят. В термодинамические формулы входит не сама энергия, а ее изменение – Δ U, поэтому внутреннюю энергию можно определять с точностью до аддитивной постоянной. |
Date: 2015-07-27; view: 1143; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |
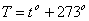 (К).
(К).
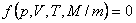 .
.
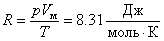 .
.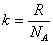 .
.
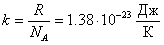 .
. .
.