
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Катализ и ингибирование
Есть вещества, которые в лияют на скорость химической реакции, не являясь при этом реагентами. Они принимают в реакции самое непосредственное участие, но в результате реакции остаются неизменными. Такие вещества называются катализаторами, если они ускоряют реакцию, и ингибиторами, если замедляют ее.
75% химической промышленности использует каталитические процессы. Среди них - как крупнотоннажные производства: синтез аммиака и его окисление, производство серной кислоты, так и тонкие многостадийные синтезы, например, лекарственных средств.
Все биохимические реакции, протекающие в живых организмах, требуют участия природных катализаторов - ферментов. Ферменты представляют собой крупные белковые молекулы с так называемым активным центром - как правило, это химически связанная с белком молекула небелковой природы или ион металла. Ферменты обладают непревзойденной активностью (т.е. скоростью каталитического процесса), ускоряя реакции в миллиарды и триллионы раз при комнатной температуре. При высоких температурах они теряют активность, так как белок денатурируется. Кроме того, ферменты характеризуются чрезвычайной избирательностью ( селективностью ), превращая лишь строго определенные вещества в строго определенные продукты. Они способны на это благодаря своей уникальной форме, к которой реагенты должны подойти, как ключ к замку.
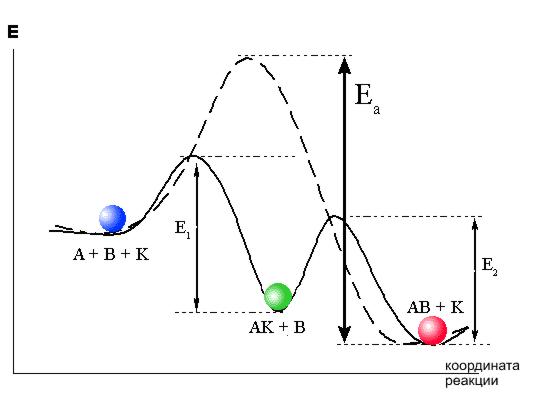
Действие катализаторов основано на том, что они уменьшают энергию активации реакции.
 Катализ и ингибирование. Дополнительный материал.
Катализ и ингибирование. Дополнительный материал.
В упрощенном виде механизм действия катализатора можно представить следующим образом. Изменение энергии активации реакции происходит за счет образования катализатором К с одним из реагентов А промежуточного соединения АК:
A + K = AK (1)
AK + B = AB + K (2)
Суммарная реакция
A + B = AB
BНо вместо энергетического барьера этой реакции преодолеваются более низкие барьеры реакций (1) и (2): E1 и E2.

Многие катализаторы не просто ускоряют реакции, а ведут их по другому пути. Так, реакция окисления аммиака без катализатора:
4NH3 + 3O2 = 2N2 + 6H2O
не представляет никакого интереса для промышленности, а в результате каталитического окисления на платине:
4NH3 + 5O2 = 4NO + 6H2O
получается ценный продукт - оксид азота(II).
Ингибиторы, наоборот, увеличивают энергию активации реакции. В пищевой промышленности широко используются ингибиторы, предотвращающие гидролиз жиров, реакции окисления и брожения.
Особый случай катализа - аутокатализ, или ускорение реакции одним из ее продуктов. При этом скорость реакции не уменьшается по мере расходования реагентов, а растет. Так, реакция
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
ускоряется по мере накопления ионов Mn2+, образующихся при восстановлении перманганата.
Date: 2015-07-27; view: 371; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |