
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Влияние температуры на скорость химической реакции
Влияние температуры на количество столкновений молекул может быть показано с помощью модели. В первом приближении влияние температуры на скорость реакций определяется правилом Вант-Гоффа (сформулировано Я. Х. Вант-Гоффом на основании экспериментального изучения множества реакций):
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:

|
где g - tтемпературный коэффициент, принимающий значения от 2 до 4.
 Влияние температуры на скорость химической реакции. Дополнительный материал.
Влияние температуры на скорость химической реакции. Дополнительный материал.
Правило Вант-Гоффа
Правило Вант-Гоффа - не более чем правило, оно не имеет силу закона.
Во-первых, Вант-Гофф мог изучать химические реакции в ограниченных условиях, которые обеспечивала лабораторная техника того времени. Как выяснилось позже, температурный коэффициент в значительном температурном интервале непостоянен.
Кроме того, из-за несовершенства технических средств невозможно было изучать как очень быстрые реакции (протекающие за миллисекунды), так и очень медленные (для которых требуются тысячи лет). Реакции с участием больших молекул сложной формы (например, белков) также не подчиняются правилу Вант-Гоффа.
Энергия активации
Молекула - энергетически выгодное образование (в противном случае никаких молекул не существовало бы). Это значит, что химические вещества на энергетической диаграмме занимают положение в "ямках".
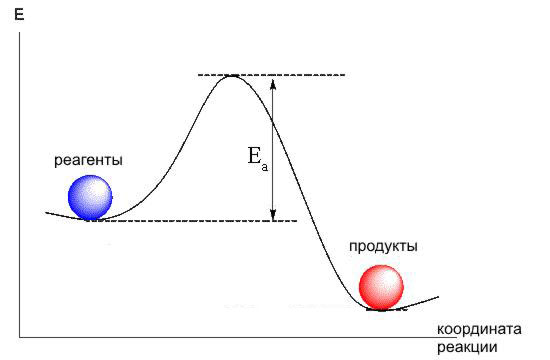
Если мы хотим провести реакцию, т.е. превратить эти вещества в другие, мы должны сообщить реагентам энергию, достаточную для того, чтобы они выбрались из "ямки", перевалили через окружающий его "барьер" ( энергию активации ).
 Для этого, как правило, требуется нагреть реакционную смесь до определенной температуры, чтобы увеличить кинетическую энергию молекул. Если энергетический барьер реакции невысок, для ее начала бывает достаточно удара или трения.
Для этого, как правило, требуется нагреть реакционную смесь до определенной температуры, чтобы увеличить кинетическую энергию молекул. Если энергетический барьер реакции невысок, для ее начала бывает достаточно удара или трения.
Объяснение зависимости скорости реакции от температуры было дано С.Аррениусом. К реакции приводит не каждое столкновение молекул реагентов, а только наиболее сильные столкновения. Лишь молекулы, обладающие избытком кинетической энергии, способны к химической реакции.
С.Аррениус рассчитал долю активных (т.е. приводящих к реакции) соударений реагирующих частиц a, зависящую от температуры: - a = exp(-E/RT). и вывел уравнение Аррениуса для константы скорости реакции:
k = koe-E/RT
где ko и E dзависят от природы реагентов. Е - это энергия, которую надо придать молекулам, чтобы они вступили во взаимодействие, называемая энергией активации.
Date: 2015-07-27; view: 389; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |