
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Расчет теплоты горения
Энтальпией горения (DНгор, кДж/моль) вещества называется тепловой эффект реакции окисления 1 моль горючего вещества с образованием высших оксидов.
Теплота горения (Qгор) численно равна энтальпии горения, но противоположна по знаку.
Для индивидуальных веществ тепловой эффект реакции может быть рассчитан по
I следствию закона Гесса.
| Расчет теплового эффекта реакции горения индивидуального вещества | Пример 3.1. Рассчитать тепловой эффект реакции горения 1 моль бутана С4Н10. |
1. Запишем уравнение реакции горения бутана.
С4Н10 + 6,5(О2 +3,76 N2) = 4СО2 + 5Н2О + 6,5×3,76 N2
2. Выражение для теплового эффекта этой реакции по I следствию закона Гесса
DН0р-и = 4DН0(СО2) + 5DН0(Н2О) - DН0(С4Н10).
3. По таблице 1 приложения находим значения энтальпий образования углекислого газа, воды (газообразной) и бутана.
DН0(СО2) = -393,5 кДж/моль; DН0(Н2О) = - 241,8 кДж/моль;
DН0(С4Н10) = - 126, 2 кДж/моль.
Подставляем эти значения в выражение для теплового эффекта реакции
DН0р-и = 4×(–393,5) + 5×(–241,8) – (- 126,2) = - 1656,8 кДж
DН0р-и = DН0гор = - 1656,8 кДж/моль или Qгор = + 1656,8 кДж/моль.
Таким образом, при сгорании 1 моля бутана выделяется 1656,8 кДж тепла.
В пожарно-технических расчетах часто пользуются понятием удельной теплоты горения. Удельная теплота горения – это количество теплоты, которое выделяется при полном сгорании единицы массы или объема горючего вещества. Размерность удельной теплоты горения – кДж/кг или кДж/м3.
В зависимости от агрегатного состояния воды в продуктах горения различают низшую и высшую теплоту горения. Если вода находится в парообразном состоянии, то теплоту горения называют низшей теплотой горения Qн. Если пары воды конденсируются в жидкость, то теплота горения – высшая Qв.
Температура пламени достигает 100 К и выше, а вода кипит при 373 К, поэтому в продуктах горения на пожаре вода всегда находится в парообразном состоянии, и для расчетов в пожарном деле используется низшая теплота горения Qн.
Низшая теплота горения индивидуальных веществ может быть определена переводом значения DНгор, кДж/моль в Qн, кДж/кг или кДж/м3. Для веществ сложного элементного состава низшая теплота горения может быть определена по формуле Д.И. Менделеева. Кроме того, для многих веществ значения низшей теплоты горения приведены в справочной литературе, некоторые данные представлены в приложении 2.
| Перевод значения энтальпии горения из кДж/моль в кДж/кг | Пример 3.2. Энтальпия горения этилацетата СН3СООС2Н5 равна DНгор = - 2256,3 кДж/моль. Выразить эту величину в кДж/кг. |
Значение DНгор = - 2256,3 кДж/моль показывает, что при сгорании 1 моля этилацетата выделяется 2256,3 кДж тепла, т.е. Qгор = + 2256,3 кДж/моль.
1 моль СН3СООС2Н5 имеет массу 88 г. Можно составить пропорцию
М (СН3СООС2Н5) = 88 г/моль ¾ Qгор = 2256,3 кДж/моль
1 кг = 1000 г ¾ Qн кДж/кг
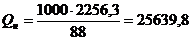 кДж/кг
кДж/кг
В общем виде формула для перевода из размерности кДж/моль в кДж/кг выглядит следующим образом:
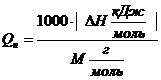 ; кДж/кг (3.1)
; кДж/кг (3.1)
Если необходимо осуществить перевод из размерности кДж/моль в кДж/м3, то можно воспользоваться формулой
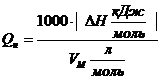 , кДж/м3. (3.2)
, кДж/м3. (3.2)
| Расчет низшей теплоты сгорания Qн по формуле Д.И. Менделеева | Пример 3.3. Вычислить низшую теплоту сгорания сульфадимезина С12Н14О2N4S по формуле Д.И. Менделеева. |
Значения низшей теплоты сгорания веществ и материалов могут быть рассчитаны по формуле Д.И.Менделеева. Данная формула может быть использована для расчетов Qн веществ сложного элементного состава, а также для любых индивидуальных веществ, если предварительно рассчитать массовую долю каждого элемента в соединении (w).
QН = 339,4×w(C) + 1257×w(H) - 108,9 [(w(O) +w(N)) -w(S)] - 25,1[9×w(H) +w(W)], кДж/кг,
(3.3)
где
w (С), w (Н), w (S), w (О),w (N) – – массовые доли элементов в веществе, %; w (W) – содержание влаги в веществе, %.
1. Для того, чтобы воспользоваться данной формулой, необходим расчет процентного состава каждого элемента в веществе (массовой доли).
Молярная масса сульфадимезина С12Н14О2N4S составляет 278 г/моль.
w(C) = (12×12)/278 = 144/278 = 0,518 ×100 = 51,8 %
w(H) = (1×14)/278 = 14/278 = 0,05 ×100 = 5,0 %
w(O) = (16×2)/278 = 32/278 = 0,115 ×100 = 11,5 %
w(N) = (14×4)/278 = 56/278 = 0,202 ×100 = 20,2 %
w(S) = 100 – (51,8 + 5,0 + 11,5 + 20,2) = 11,5 %
2. Подставляем найденные значения в формулу Д.И. Менделеева.
QН = 339,4×51,8+1257×5,0-108,9×(11,5+20,2-11,5)-25,1×9×5,0 = 22741 кДж/кг.
Теплота горения смеси газов и паров определяется как сумма произведений теплот горения каждого горючего компонента (Qн) на его объемную долю в смеси (jоб):
Qн = 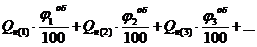 , кДж/м3. (3.4)
, кДж/м3. (3.4)
Можно воспользоваться эмпирической формулой для расчета Qн для газовой смеси:
Qн = 126,5×j(СО) + 107,7×j(Н2) + 358,2×j(СН4) + 590,8×j(С2Н4) + 636,9×j(С2Н6) + 913,4×j(С3Н8) + 1185,8×j(С4Н10) + 1462,3×j(С5Н12) + 234,6×j(Н2S), кДж/м3(3.5)
Date: 2015-07-27; view: 6357; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |