
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Цепные неразветвленные реакции. Рассмотреть на примере реакции водорода с хлором
В принципе этот процесс может протекать через простые двойные столкновения Н2+ Сl2=2HCl
Однако цепные реакции протекают настолько быстро, что бимолекулярная реакция не имеет никакого значения.
Первичными активными центрами являются атомы хлора при столкновении с некоторой третьей частицей М.. Образование активных центров называется реакцией зарождения цепей. Реакции, сопровождающие исчезновение свободной валентности называются реакциями обрыва цепей

k1 - константа скорости первой реакции и т.д.
Используя предположение о квазистационарности, получаем уравнения для скоростей образования и расходования промежуточных компонентов Н и С1:
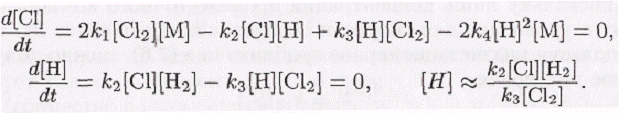
Сложение этих уравнений для скорости позволяет получить выражение для концентрации [С1]:

Тогда выражение для скорости образования НС1 примет вид
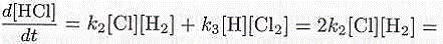

Таким образом, скорость образования хлорида водорода можно выразить через концентрации исходных реагентов (Н2 и С12). Концепция квазистационарных состояний позволяет получать результаты несмотря на то, что исходная система кинетических уравнений представляет собой систему связанных между собой дифференциальных уравнений, которую нельзя решить аналитически. Кроме того, пример реакции водорода с хлором показывает, что суммарная реакция не подчиняется закону второго порядка по концентрации (как можно было бы интуитивно ожидать). В этом случае первый порядок реакции по водороду и ½ порядок реакции по концентрации молекулярного хлора. Формально можно предположить, что реакции идет через атом хлора. Однако, это лишь указывает на цепной характер реакции. Впрочем отсутствие дробной степени также не устраняет возможность сложного механизма с участием промежуточных активных веществ.
Задача
Дано:
Г.В. – Пропиловый спирт C3Н7OH;
Температура t = 28 оС (301 К);
Давление Р = 112 кПа;
К–т избытка воздуха µ =1,2;
G = 0,17 г/м2с;
Объем помещения Vпом = L*B*H=60*6*4,5=1620 м3;
Поверхность испарения Sис = 3 м2.
Определить:
Vв; Vпг; % состав П.Г.; Qн; tг; d; Cнас; Cст; Рвз; НКПР; ВКПР; НТПР; ВТПР; tвс; tис.
Решение
1. Рассчитаем объём воздуха, необходимого для полного сгорания 1 кг горючего вещества
а) Составим уравнение реакции горения пропилового спирта на воздухе (сохраняем перед формулой Г.В. коэффициент nгв = 1).
C3H7OH + 4,5О2 + 4,5´3,76 N2 = 3 СО2 + 4 Н2О+ 4,5´3,76 N2
б) Опр. массу 1 Кмоля Г.В.: М = 12 ´ 3 + 1 ´ 8 + 16 ´ 1 =36+8+16=60 кг
в) Опр. объём 1 Кмоля любого газа или пара при заданных условиях:

Объём любого газа из уравнения реакции горения можно определить по формуле: Vi = 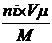 ,
,
где ni – количество Кмолей соответствующего газа или пара:
nгв=1; nСО2 =3; nН2О= 4; nО2 = 4,5; nN2=4,5´3,76.
г) Опр. реальный расход воздуха с учётом заданных условий и избытка воздуха:
Vв= 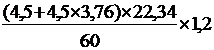 = 9,57 м3
= 9,57 м3
2. Определим объём и процентный состав продуктов горения 1 кг пропилового спирта
а) опр. объём п.г.:
VО2и = 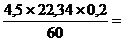 0, 35м3
0, 35м3
VCO2 =  = 1,11 м3
= 1,11 м3
VN2 =  = 7,55 м3
= 7,55 м3
VH2O = 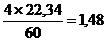 м3
м3
VПГ = VCO2 + VH2O + VN2 + VО2и = 1,11 + 1,48 + 7,55 + 0,35 = 10,49 м3
б) Опр. % состав П.Г., приняв Vпг за 100%. ji = 
jСО2 = 
jН2О = 
jО2 = 
jN2 = 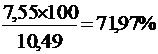
Date: 2015-07-27; view: 1157; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |