
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Регуляция с помощью белок-белковых взаимодействий
Некоторые ферменты изменяют свою каталитическую активность в результате белок-белковых взаимодействий. 2 механизма активации ферментов:
1. активация ферментов в результате присоединения регуляторных белков. Пример – активация аденилатциклазы, локализованной в плазматической мембране клетки. Активный центр аденилатциклазы локализован на цитоплазматической стороне плазматической мембраны. Активированная аденилатциклаза катализирует реакцию образования циклической АМФ из АТФ. В мембране аденилатциклаза функционирует в комплексе с другими белками (рецепторами гормонов, с G-белком – состоящим из 3-х субъединиц, α, β, γ. α-субъединица имеет центр связывания и расщепления ГТФ). Гормон, взаимодействуя с рецептором на поверхности клеток, приводит к уменьшению сродства ГТФ-связывающего белка (G-белка) к ГДФ и увеличению сродства к ГТФ. Присоединение молекулы ГТФ к активному центру G-белка вызывает диссоциацию комплекса на субъединицы α-ГТФ и димер βγ. Комплекс α-ГТФ активирует аденилатциклазу, что способствует синтезу из АТФ молекул цАМФ, аденилциклазы, протеинкиназы и фосфорной кислоты.

2. регуляция активности ферментов путем ассоциации-диссоциации протомеров. В тканях присутствуют ферменты, которые в неактивной форме представлены отдельными комплексами, состоящими из нескольких протомеров. При увеличении в клетке концентрации специфических регуляторных молекул они присоединяются к определенным центрам протомеров. Изменение их конформации, вызванное присоединением лигандов, повышает их сродство друг к другу и стимулирует ассоциацию, т.е. образование активной формы фермента.
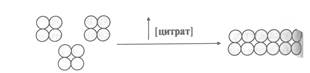
неактивные протомеры активная ацетил-СоА
ацетил-СоА карбоксилазы карбоксилаза
Веществом, которое изменяет конформацию комплексов, является цитрат. При повышении его концентрации в цитозоле клетки 3 тетрамера объединяются в олигомер из 12 протомеров – активную форму ацетил-СоА карбоксилазы.
Другим примером этого типа регуляции может служить активация протеинкиназы А. В неактивной форме фермент состоит из 4 протомеров – 2 каталитических и 2 регуляторных. Регуляторные протомеры имеют по 2 центра связывания для молекул регуляторного лиганда – циклического АМФ. Молекулы цАМФ при повышении их концентрации в клетке присоединяются к специфическим центрам регуляторных протомеров. Это приводит к изменению их конформации и потере сродства к каталитическим протомерам. Отделившиеся каталитические протомеры (протеинкиназы А) проявляют протеинкиназную активность и фосфорилируют белки по аминокислотным остаткам серина и треонина. В отсутствие цАМФ регуляторные протомеры взаимодействуют с каталитическими протомерами, образуя неактивный комплекс.
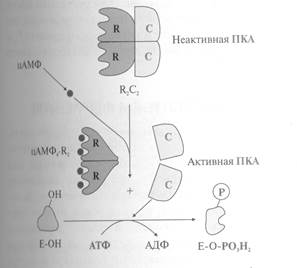
Синтез молекул цАМФ из АТФ катализирует фермент аденилатциклаза, а превращение цАМФ в АМФ – фосфодиэстераза.

Регуляция путем фосфорилирования/дефосфорилирования фермента
Широко распространенный способ химической модификации ферментов фосфорилирование/дефосфорилирование белков осуществляют ферменты протеинкиназы (класс трансферазы). Они катализируют образование сложноэфирной связи между фосфатной группой и ОН-группой аминокислотных остатков серина, треонина и тирозина. Донором фосфатной группы является АТФ.
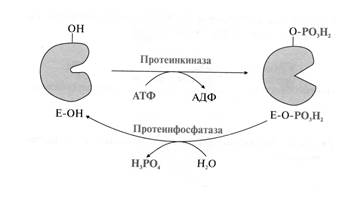
В результате фосфорилирования происходит изменение заряда, конформации фермента, конформации активного центра фермента. повышается сродство фермента к субстрату и возрастает скорость ферментативной реакции.
Например – триацилглицерол-липаза (ТАГ-липаза) – внутриклеточный фермент жировой ткани. В дефосфорилированной форме фермент неактивен. Под действием специфической протеинкиназы А фермент фосфорилируется и переходит в активную форму.
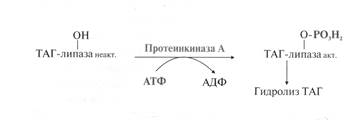
Для некоторых ферментов, обеспечивающих метаболизм глюкозы, холестерола, гликогена, фосфорилированная форма является неактивной. Например, фермент пируваткиназа, участвующая в катаболизме глюкозы, переходит в активную форму только после отщепления фосфорного остатка. Поэтому в этом случае фосфорилирование вызывает снижение активности, а дефосфорилирование – повышение активности фермента. Дефосфорилирование осуществляют протеинфосфатазы (класс гидролазы)

Date: 2015-07-27; view: 3326; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |