
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Електронна теорія кислот і основ або теорія Льюїса
Теория кислот и оснований Льюиса, в отличие от теории Бренстеда, является более общей. Согласно этой теории основанием считается любая частица (атом, молекула или анион), способная отдавать электронную пару для образования ковалентной связи, а кислотой — любая частица (атом, молекула, катион), способная принимать пару электронов с образованием ковалентной связи.
То есть, по Льюису, основание является донором, а кислота — акцептором пары электронов. Из приведенного определения видно, что основания Льюиса тождественны основаниям Бренстеда. Однако кислоты Льюиса охватывают более широкий круг соединений.
Кислотой Льюиса считается любая частица, имеющая вакантную орбиталь.
Согласно теории Льюиса, к кислотам относятся не только соединения, отщепляющие протон (протонные кислоты), но и другие вещества, имеющие вакантную орбиталь и способные принимать пару электронов (апротонные кислоты). Кислотами Льюиса, например, являются такие соединения, как BF4, AIC1,, FeCI3, SbCI,, ZnClr HgCI3 и др.
Кислотно-основный процесс по Льюису состоит в образовании ковалентной связи между основанием и кислотой за счет электронной пары основания и вакантной орбитали кислоты. Так. основания Льюиса, имеющие неподеленные пары электронов, образуют с кислотами Льюиса комплексы.
Види гібридизації атомних орбіталей Карбону, Нітрогену, Оксигену. Ковалентні α- і π-зв'язки. Електронна будова подвійних і потрійних карбон-карбонових зв'язків. Спряжені системи.
В атоме углерода появляется четыре неспаренных электрона:

На втором энергетическом уровне кроме 2s-орбитали имеются три 2р-орбитали. Эти 2р-орбитали имеют эллипсоидную форму, похожую на гантели, и ориентированы в пространстве под углом 90° друг к другу. 2р-Орбитали обозначают 2рх, 2рy и 2рz в соответствии с осями, вдоль которых эти орбитали расположены.
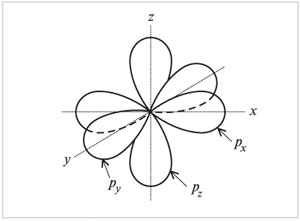
При образовании химических связей электронные орбитали приобретают одинаковую форму. Так, в предельных углеводородах смешиваются одна s-орбиталь и три р-орбитали атома углерода с образованием четырех одинаковых (гибридных) sр3-орбиталей:
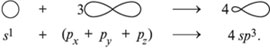
Это – sр3-гибридизация.
Гибридизация – выравнивание (смешивание) атомных орбиталей (s и р) с образованием новых атомных орбиталей, называемых гибридными орбиталями.
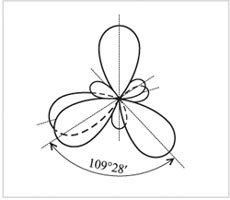
Вершины электронных орбиталей могут перекрываться с орбиталями других атомов. Если электронные облака перекрываются по линии, соединяющий центры атомов, то такую ковалентную связь называют сигма()-связью. Например, в молекуле этана С2Н6 химическая связь образуется между двумя атомами углерода перекрыванием двух гибридных орбиталей. Это сигма-связь. Кроме того, каждый из атомов углерода своими тремя sр3-орбиталями перекрывается с s-орбиталями трех атомов водорода, образуя три сигма-связи.
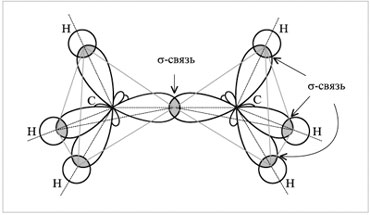
Кроме sр3-гибридизации существует sр2- и sр-гибридизация.
sр2-Гибридизация – смешивание одной s- и двух р-орбиталей. В результате образуются три гибридные sр2-орбитали. Эти sр2-орбитали расположены в одной плоскости (с осями х, у) и направлены к вершинам треугольника с углом между орбиталями 120°. Негибридизованная р-орбиталь перпендикулярна к плоскости трех гибридных sр2-орбиталей (ориентирована вдоль оси z). Верхняя половина р-орбитали находится над плоскостью, нижняя половина – под плоскостью.
Тип sр2-гибридизации углерода бывает у соединений с двойной связью: С=С, С=О, С=N. Причем только одна из связей между двумя атомами (например, С=С) может быть сигма-связью. (Другие связывающие орбитали атома направлены в противоположные стороны.) Вторая связь образуется в результате перекрывания негибридных р-орбиталей по обе стороны от линии, соединяющей ядра атомов.
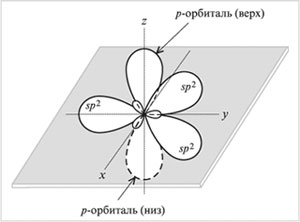 Орбитали (три sp2 и одна р) атома углерода в sp2
Орбитали (три sp2 и одна р) атома углерода в sp2
Ковалентная связь, образующаяся путем бокового перекрывания р-орбиталей соседних углеродных атомов, называется пи()-связью.
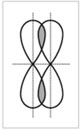
Из-за меньшего перекрывании орбиталей пи-связь менее прочная, чем сигма-связь.
sр-Гибридизация – это смешивание (выравнивание по форме и энергии) одной s- и одной р-орбиталей с образованием двух гибридных sр-орбиталей. sр-Орбитали расположены на одной линии (под углом 180°) и направлены в противоположные стороны от ядра атома углерода. Две р-орбитали остаются негибридизованными. Они размещены взаимно перпендикулярно направлениям сигма -связей. На рисунке sр-орбитали показаны вдоль оси y, а негибридизованные две р-орбитали– вдоль осей х и z.
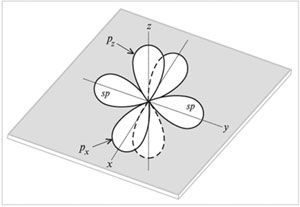
Тройная углерод-углеродная связь СС состоит из -связи, возникающей при перекрывании sp-гибридных орбиталей, и двух -связей.
Тройная-sp-2сигма,2пи
Двойная-sp2-3сигма,1пи
Одинарная-sp3-4сигма
Сопряжение связей (конъюгация связей)- это, в простейшем случае, чередование простых и кратных связей в структурной формуле соединения. CH2=CH-CH=CH2
Квантовая химия рассматривает сопряжение связей как взаимод. между орбиталями отдельных фрагментов молекулы, к-рое может осуществляться по тому или иному механизму. Напр., s-сопряжению соответствует взаимод. орбиталей простых связей, p-сопряжению - взаимод. орбиталей кратных связей. s-Сопряжение связей всегда присутствует в любой молекуле, состоящей из трех или большего числа атомов. В то же время наблюдаемые св-ва полиенов и аннуленов описываются исходя из представлений как s-, так и p-сопряжения.
В простейшем случае сопряженные системы это системы с чередующимися двойными и одинарными связями. Они могут быть открытыми и закрытыми. Открытая система имеется в диеновых углеводородах (УВ).
Все атомы С находятся в состоянии sp-гибридиза-ции. Четыре негибридные р-орбитами, перекрываясь между собой, образуют единую электронную систему. Этот вид сопряжения называется p, p-сопряжением.
Происходит сопряжение р-электронов с S-электро-нами. Этот вид сопряжения называется р, р-сопряже-нием. Закрытая система имеется в ароматических УВ.
Сопряжение – процесс энергетически выгодный, энергия (Е) при этом выделяется.
Date: 2015-07-27; view: 903; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |