
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Источники потерь. 5 page
Для вновь проектируемых котельных агрегатов значения qv выбирают по нормативным данным в зависимости от вида сжигаемого топлива, способа сжигания и конструкции топочного устройства. При балансовых испытаниях эксплуатируемых котельных агрегатов величину Q3 рассчитывают по данным газового анализа.
При сжигании твердого или жидкого топлива величину Q3, кДж/кг, можно определить по формуле  (19.7)
(19.7)
3.Потеря теплоты от механической неполноты сгорания топлива Q4(g4). При горении твердого топлива остатки (зола, шлак) могут содержать некоторое количество несгоревших горючих веществ (в основном углерода). В результате химически связанная энергия топлива частично теряется.
Потеря теплоты от механической неполноты сгорания включает ее потери вследствие:
- провала мелких частиц топлива через зазоры в колосниковой решетке Qпр (qпр);
- удаление некоторой части недогоревшего топлива со шлаком и золой Qшл (qшл);
- уноса мелких частиц топлива дымовыми газами Qун (qун)
Q4 - Qпp + Qун + Qшл
Потеря теплоты qyн принимает большие значения при факельном сжигании пылевидного топлива, а также при сжигании неспекающихся углей в слое на неподвижных или подвижных колосниковых решетках. Значение qун для слоевых топок зависит от видимого удельного энерговыделения (теплонапряжения) зеркала горения qR, кВт/м2, т.е. от количества выделяющейся тепловой энергии, отнесенного к 1 м2 горящего слоя топлива.
Допустимое значение qR BQр/н/R (В - расход топлива; R - площадь зеркала горения) зависит от вида сжигаемого твердого топлива, конструкции топки, коэффициента избытка воздуха и т.д. В слоевых топках современных котельных агрегатов величина qR имеет значения в пределах 800 - 1100 кВт/м2. При расчете котельных агрегатов величины qR, q4 = qnp + qшл + qун принимают по нормативным материалам. При балансовых испытаниях потерю теплоты от механического недожога рассчитывают по результатам лабораторного технического анализа сухих твердых остатков на содержание в них углерода. Обычно для топок с ручной загрузкой топлива q4 = 5 ÷ 10%, а для механических и полумеханических топок q4 = 1 ÷ 10%. При сжигании пылевидного топлива в факеле в котельных агрегатах средней и большой мощности q4 = 0,5 ÷ 5%.
4. Потеря теплоты в окружающую среду Q5 (q5) зависит от большого числа факторов и главным образом от размеров и конструкции котла и топки, теплопроводности материала и талщины стенок обмуровки, тепловой производительности котлоагрегата, температуры наружного слоя обмуровки и окружающего воздуха и т. д.
Потери теплоты в окружающую среду при номинальной производительности определяют по нормативным данным в зависимости от мощности котлоагрегата и наличия дополнительных поверхностей нагрева (экономайзера). Для паровых котлов производительностью до 2,78 кг/с пара q5 - 2 - 4%, до 16,7 кг/с - q5 - 1 - 2%, более 16,7 кг/с - q5 = 1 - 0,5%.
Потери теплоты в окружающую среду распределяются по различным газоходам котлоагрегата (топка, пароперегреватель, экономайзер и т.д.) пропорционально теплоте, отдаваемой газами в этих газоходах. Эти потери учитывают, вводя коэффициент сохранения теплоты φ = 1 q5/(q5 + ȵк.а) где ȵк.а - КПД котельного агрегата.
5. Потеря теплоты с физической теплотой удаляемых из топок золы и шлаков Q6(q6) незначительна, и ее следует учитывать только при слоевом и камерном сжигание многозольных видов топлива (типа бурых углей, сланцев), для которых она составляет 1 - 1,5%.
Потери теплоты с горячей золой и шлаком q6, %, рассчитывают по формуле
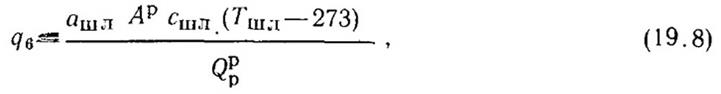
где ашл - доля золы топлива в шлаке; Сшл - теплоемкость шлака; Тшл - температура шлака.
При факельном сжигании пылевидного топлива ашл = 1 - аун (аун - доля золы топлива, уносимой из топки с газами).
Для слоевых топок асл шл = ашл + апр (апр - доля золы топлива в "провале"). При сухом шлакоудалении температура шлака принимается Тш = 870 К.
При жидком шлакоудалении, которое наблюдается иногда при факельном сжигании пылевидного топлива Тшл = Тзол + 100 К (Тзол - температура золы в жидкоплавком состоянии). При слоевом сжигании горючих сланцев к зольности Aр вводится поправка на содержание углекислоты карбонатов, равная 0,3 (СО2), т.е. зольность принимается равной АР + 0,3 (СО2)р/к. Если удаляемый шлак находится в жидком состоянии, то значение величины q6 достигает 3%.
В печах и сушилках, применяемых в промышленности строительных материалов, помимо рассмотренных потерь теплоты приходится учитывать также потери на прогрев транспортных устройств (например, вагонеток), на которых материал подвергается тепловой обработке. Эти потери могут доходить до 4% и более.
Таким образом, КПД "брутто" может быть определен как
ȵк.а = g1 - 100 - ∑q потерь(19.9)
Теплоту, воспринятую вырабатываемым продуктом (пар, вода), обозначим Qк.a, кВт, тогда имеем:
для паровых котлов
Q1 = Qк.а = D (in.n – iп.н)+ pD/100 (i - iп.в) (19.10)
для водогрейных котлоагрегатов
Q1 = Qк.а = Мв ср.в (Твых – Твх) (19.11)
Где D - производительность котла, кг/с; iп.п - энтальпия перегретого пара (если котел вырабатывает насыщенный пар, то вместо iп.в следует поставить (iпн) кДж/кг; iп.в - энтальпия питательной воды, кДж/кг; р - количество воды, удаляемой из котлоагрегата с целью сохранения допустимого содержания солей в котловой воде (так называемая непрерывная продувка котла), %; i - энтальпия котловой воды, кДж/кг; Мв - расход воды через котлоагрегат,кг/с; ср.в - теплоемкость воды, кДж/(кгК); Tвых - температура горячей воды на выходе из котла; Твх - температура воды на входе в котел.
Расход топлива В, кг/с или м3/с, определяют по формуле
B = Qк.a/(Qр/н ȵк.a) (19.12)
Объем продуктов сгорания (см. § 18.5) определяют без учета потери от механического недожога. Поэтому дальнейший расчет котельного агрегата (теплообмен в топке, определение площади поверхностей нагрева в газоходах, воздухоподогревателя и экономайзера) осуществляется по расчетному количеству топлива Вр:
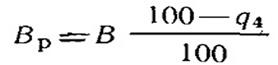 (19.13)
(19.13)
При сжигании газа и мазута Вр = В.
47. Абсорбция – поглощение газов или паров из газовых или паровых смесей жидкими поглотителями, называемыми абсорбентами. Возможность осуществления процесса абсорбции основывается на растворимости газов в жидкостях. Процесс абсорбции является избирательным и обратимым, что даёт возможность применять его не только с целью получения растворов газов в жидкостях, но также и для разделения газовых или паровых смесей.
В последнем случае после избирательной абсорбции одного или нескольких компонентов из газовой или паровой смеси проводят десорбцию – выделение этих компонентов из жидкости – и таким образом осуществляют разделение. Регенерированный абсорбент вновь возвращается на абсорбцию (круговой процесс).
Различают физическую абсорбцию и хемосорбцию. При физической абсорбции растворение газа не сопровождается химической реакцией. При хемосорбции абсорбируемый компонент вступает в химическую реакцию в жидкой фазе.
Примерами использования процессов абсорбции в технике могут служить разделение углеводородных газов на нефтеперерабатывающих установках, получения соляной кислоты, получения аммиачной воды, очистка отходящих газов с целью улавливания ценных продуктов или обезвреживание газосбросов и другие.
Аппаратурно-технологическое оформление процессов сравнительно просто, поэтому процессы абсорбции широко используются в технике.
Абсорбционные аппараты в зависимости от форм контакта газа (пара) и жидкости делят на абсорберы: поверхностные, плёночные, насадочные, барботажные, распылительные.
Одним из наиболее распространённых абсорберов поверхностного типа является насадочный колонный аппарат.
Насадочные абсорберы – колонные аппараты, заполненные насадками – твёрдыми телами различной формы. Основным назначением насадки является распределение плёнки жидкости по всей поверхности для создания развитой поверхности межфазового контакта.
Эффективная насадка должна отвечать следующим требованиям: обладать большой поверхностью в единице объема; хорошо смачиваться орошающей жидкостью; оказывать малое гидравлическое сопротивление газовому потоку; равномерно распределять орошающую жидкость; обладать химической стойкостью к воздействию жидкости и газа, контактирующих в аппарате; иметь малый удельный вес; обладать высокой механической прочностью; иметь низкую стоимость. Поскольку универсальной насадки не существует, выбор её обуславливается конкретными условиями применения.
Насадочные аппараты отличаются простотой устройства, возможностью работы с агрессивными средами, созданием высокой удельной поверхности контакта фаз и коэффициентами массопередачи.

Рис. 1. Схема насадочного абсорбера
1 – насадка; 2 – опорная решетка; 3 – перераспределитель жидкости;
4 – разбрызгиватель
В насадочной колонне (Рис. 1) насадка 1 укладывается на опорные решетки 2, имеющие отверстия или щели для прохождения газа и стока жидкости, которая с помощью распределителя (разбрызгивателя) 4 равномерно орошает насадочные тела и стекает вниз. По всей высоте слоя насадки равномерное распределение жидкости по сечению колонны обычно не достигается, поскольку из-за разного гидравлического сопротивления насадки и влияния пристеночных эффектов, она имеет тенденцию растекаться от центральной части колонны к её стенкам. Поэтому для улучшения смачивания насадки в колоннах большого диаметра насадку иногда укладывают слоями (секциями) высотой 2…3 м и под каждой секцией, кроме нижней, устанавливают перераспределители жидкости 3.
Физико-химические свойства, методы получения продуктов, участвующих в процессе.
Метиловый спирт (метанол) CH3ОН, носящий ещё название древесного спирта (по старому способу его получения – сухой перегонкой дерева), представляет собой бесцветную жидкость, кипящую при 64,7ºC. Обладает характерным спиртовым запахом, горит бледным пламенем. Метиловый спирт сильно ядовит. При принятии внутрь вызывает тяжёлое отравление, сопровождаемое потерей зрения; может привести к смертельному исходу.
Метиловый спирт применяется в больших количествах в химической промышленности для синтеза различных органических продуктов. Широко применяется во многих отраслях промышленности в качестве растворителя. В промышленности в основном получается из синтез-газа, образующегося в результате конверсии метана. Реакция проводится при температуре 300–600ºC и давлении 200–250 кгс/ см2 в присутствии окиси цинка и других катализаторов
CO + 2H2 → CH3OH.
Вода – самое распространённое вещество на земле. Почти ¾ поверхности земного шара покрыто водой, заполняющей все природные водоёмы и образующей океаны, моря, реки и озёра. Много воды находится в газообразном состоянии в виде паров в атмосфере; огромными массами снега и льда лежит вода круглый год на вершинах высоких гор и в полярных странах. Не только на поверхностях земли, но и её недрах находится вода, пропитывающая почву и различные горные породы и дающая начало источникам и ключам.
Природная вода никогда не бывает чистой. Наиболее чистой является дождевая вода, но и она содержит различные примеси, которые захватывает из воздуха, например растворённые газы, пыль, микроорганизмы.
Физические свойства воды. Чистая вода представляет собой бесцветную прозрачную жидкость, не имеющую ни запаха, ни вкуса. В отличие от большинства от других веществ, плотность которых при охлаждении непрерывно увеличивается, вода обладает при 4ºC наибольшей плотностью. Как выше, так и ниже этой температуры плотность воды меньше. Указанная аномалия воды имеет очень большое значение. Благодаря ей глубокие водоёмы не промерзают зимой до дна и в них сохраняется жизнь.
Не меньшее значение в жизни природы имеет и другая аномалия воды – из всех твёрдых и жидких веществ вода имеет наибольшую теплоёмкость. Поэтому в зимнее время она медленно остывает, а летом медленно нагревается, являясь, таким образом, регулятором температуры на земном шаре. 
Весовой состав воды выражается следующими числами:11,11% водорода и 88,89 % кислорода. Отсюда простейшая формула воды H2O.
Определение молекулярного веса воды по плотности её пара при высоких температурах даёт величину, равную 18, что отвечает простейшей формуле.
Х имические свойства воды. Из химических свойств воды, прежде всего, следует отметить большую устойчивость её молекул по отношению к нагреванию. Однако при температурах выше 1000ºC водяной пар начинает заметно диссоциировать на водород и кислород:
2H2O  2H2 + O2– 136,6 ккал
2H2 + O2– 136,6 ккал 
Так как этот процесс проходит с поглощением тела, то, согласно принципу Ле – Шателье, повышение температуры должно сдвигать равновесие вправо. Однако даже при 2000ºC степень диссоциации составляет только 1,8%. При охлаждении ниже 1000ºC равновесие практически почти полностью сдвигается полностью образования воды; при обыкновенной температуре свободных молекул водорода и кислорода остаётся такое ничтожное количество, что мы их не можем обнаружить.
Несмотря на устойчивость при нагревании, вода является весьма реакционноспособным веществом. Окислы многих металлов и металлоидов соединяются с водой, образуя основания и кислоты; многие соли образуют с водой кристаллогидраты; наиболее активные металлы взаимодействуют с водой с выделением водорода и т.д.
Date: 2015-08-15; view: 630; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |