
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Коррозия и коррозионностойкие материалы
ОБЩИЕ СВЕДЕНИЯ (Ю.П. Солнцев)
Коррозией называют разрушение материалов под влиянием окружающей среды в результате ее химического или электрохимического воздействия (коррозия происходит от латинского слова «corrodere» — разъедать, разрушать).
Обычно рассматривают коррозию металлических материалов. Однако это явление характерно не только для металлов и сплавов, аналогичные процессы могут происходить и в неметаллических материалах — пластмассах, керамике. Примером такого воздействия может служить износ футеровки плавильных печей под действием жидкого, химически активного шлака.
Ущерб, причиняемый коррозией, может быть прямым и косвенным. Прямой ущерб включает в себя стоимость замены подвергшихся коррозии частей машин, трубопроводов, устройств. Для восстановления пораженных коррозией оборудования и конструкций ежегодно расходуется не менее 10 % продукции мирового металлургического производства.
Косвенный ущерб от коррозии связан с простоем оборудования в результате аварий, ухудшением качества продукции, например в результате ее загрязнения, увеличением расхода топлива, материалов, энергии. Так, при выходе из строя химической аппаратуры не выпускается продукция, отказ в работе двигателей приводит к простою ценного оборудования, нарушение герметичности газо- и нефтепроводов делает возможным утечку ценного сырья. Если в результате коррозии водопроводной системы прекращается подача воды на завод, то ремонт водопровода будет стоить во много раз меньше, чем расходы, связанные с остановкой завода на несколько часов. В зависимости от страны и климатических условий суммарный ущерб, наносимый коррозией, достигает уровня 3–10 % валового продукта.
Проникновение в результате коррозии газа, нефти и других продуктов в окружающую среду приводит не только к материальным потерям, но и к угрозе жизнеобеспечения человека и природы. Если ущерб от замены и ремонта оборудования можно хотя бы рассчитать, то ущерб окружающей среде не поддается расчету.
В зависимости от свойств окружающей среды и характера ее физико-химического воздействия на материал различают:
1) химическую коррозию, обусловленную воздействием сухих газов, а также жидкостей, не являющихся электролитами (нефть, бензин, фенол);
2) электрохимическую коррозию, обусловленную воздействием жидких электролитов: водных растворов солей, кислот, щелочей, влажного воздуха, грунтовых вод, то есть растворов, содержащих ионы и являющихся проводниками электричества.
Химическая коррозия. Наиболее распространенным видом химической коррозии является газовая коррозия (особенно усиливающаяся при высоких температурах), т. е. процесс взаимодействия с кислородом или активными газовыми средами (галоиды, сернистый газ, сероводород, пары серы, диоксид углерода и т. д.). При газовой коррозии разрушаются такие ответственные узлы и детали, как лопатки газовых турбин, сопла реактивных двигателей, арматура печей.
В производственных условиях чаще всего сталкиваются с окислением металлов, в случае сплавов на основе железа — с образованием окалины. Защитные свойства металлов от окисления обусловлены образованием сплошных оксидных пленок на их поверхности. Для обеспечения сплошности пленок необходимо, чтобы объем оксида V ок был больше объема металла V мет, из которого он образовался: V ок / V мет > 1. В противном случае получается прерывистая пленка, не способная эффективно защитить металл от коррозии. Такая пленка характерна для магния (V ок / V мет = 0,79), что затрудняет защиту сплавов на его основе от коррозии.
Помимо сплошности, оксидные пленки должны обладать высокими механическими свойствами, хорошо сцепляться с металлом и иметь достаточную толщину, обеспечивающую высокие защитные характеристики. Этим требованиям удовлетворяет пленка оксида хрома Cr2O3, что обусловливает высокую устойчивостъ против коррозии сталей и жаростойких сплавов с высоким содержанием хрома.
Электрохимическая коррозия — наиболее распространенный вид коррозии металлов. При электрическом контакте двух металлов, обладающих разными электродными (электрохимическими) потенциалами и находящихся в электролите, образуется гальванический элемент. Поведение металлов зависит от значения их электродного потенциала. Металл, имеющий более отрицательный электродный потенциал (анод), отдает положительно заряженные ионы в раствор и растворяется (рис. 10.1). Избыточные электроны перетекают по внешней цепи в металл, имеющий более высокий электродный потенциал (катод). Катод при этом не разрушается, а электроны из него удаляются во внешнюю среду. Чем ниже электродный потенциал металла по отношению к стандартному водородному потенциалу, принятому за нулевой уровень, тем легче металл отдает ионы в раствор, тем ниже его коррозионная стойкость. Значения электродного потенциала Е 0 разных элементов приведены ниже
| Элемент | Мg | Al | Zn | Cr | Fe | Co | Ni |
| Е 0, В | –2,37 | –1,66 | –0,76 | –0,74 | –0,44 | –0,28 | –0,25 |
| Элемент | Sn | Pb | H | Cu | Hg | Ag | Au |
| Е 0, В | –0,14 | –0,13 | +0,34 | +0,79 | +0,80 | +1,50 |
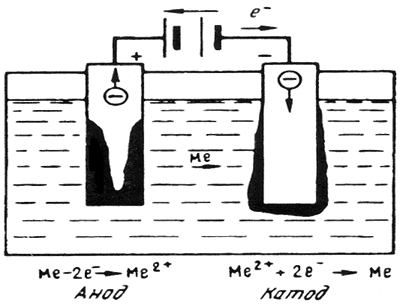
Рис. 10.1. Схема электрохимического процесса
Ход электрохимического процесса определяется разностью потенциалов элемента. Для пары Cu—Zn разность потенциалов составляет 1,1 В.
В случае замкнутой цепи медь является катодом, а цинк – анодом, что приводит к его растворению. Если приложить напряжение более 1,1 В, то анод и катод поменяются местами, что приведет к растворению меди и восстановлению металлического цинка.
ВИДЫ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ (Ю.П. Солнцев)
Приведенная схема работы гальванической пары лежит в основе электрохимической коррозии металлов и сплавов. Разные фазовые составляющие, присутствующие в структуре сплава, находясь в электролите, приобретают разные по величине и знаку электродные потенциалы. Чем больше различие в электродных потенциалах отдельных фазовых составляющих, тем активнее будет протекать коррозионный процесс и коррозионное разрушение сплава. Электрохимическая гетерогенность поверхности металла является причиной коррозии. Более коррозионностойкими являются сплавы со структурой однородного твердого раствора.
Однако даже в случае однородной структуры коррозия может развиваться за счет образования анодных областей из-за наличия межкристаллитной пористости, различия остаточных напряжений в отдельных зернах и других факторов.
Особенно сильно электрохимическая коррозия развивается в случае контакта в конструкции разнородных материалов с разными потенциалами (например, коррозия стальных деталей в контакте с медными или магниевых сплавов в контакте со сталью).
Иллюстрацией могут служить две стальные пластинки, одна из которых покрыта оловом, а другая цинком (рис. 10.2). Нарушение этих пленок приводит к тому, что из-за разности электродных потенциалов железо в пластинке с оловом становится анодом, а в пластинке с цинком, наоборот, катодом. Цинк, разрушаясь, защищает железо от коррозии. Этим объясняется долговечность строительной жести, домашних ведер, оцинкованных кузовных листов и др.
Схемы основных разновидностей электрохимической коррозии приведены на рис. 10.3.
В случае однофазного материала, например чистого металла или однородного твердого раствора, коррозия распространяется равномерно по всей поверхности детали — происходит так называемая общая или равномерная коррозия (рис. 10.3, а). Большинство коррозионно-стойких сталей хорошо сопротивляются равномерной коррозии в агрессивных средах. Высокая устойчивость сталей обусловлена их пассивным состоянием. Переход в пассивное состояние происходит самопроизвольно и связан с образованием на поверхности защитного субмикроскопического слоя с более высоким электродным потенциалом. Слой представляет собой сложный комплекс гидрооксидов. Состоянию пассивности способствует химическая устойчивость слоя в данном электролите и низкая проницаемость слоя для ионов.
В сталях пассивации способствует легирование хромом, содержание которого должно быть более 13 %.
При разрушении защитного слоя ионами Cl– и 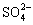 коррозионностойкие стали теряют пассивные свойства. В таких случаях вместо сталей целесообразно использовать коррозионностойкие сплавы, например, никелевый сплав с 30 % молибдена.
коррозионностойкие стали теряют пассивные свойства. В таких случаях вместо сталей целесообразно использовать коррозионностойкие сплавы, например, никелевый сплав с 30 % молибдена.
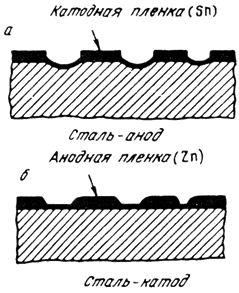
Рис. 10.2. Схема
коррозии при катодном (а) и анодном (б) защитном покрытии

Рис. 10.3. Основные разновидности электрохимической коррозии (схема) и их относительное влияние на прочность листового дуралюмина:
а) равномерная коррозия; б) местная коррозия; в) межкристаллическая коррозия
Обработка, ведущая к гомогенизации структуры, делает сплав более устойчивым против электрохимической коррозии. Примером таких обработок является закалка хромоникелевой коррозионностойкой стали или отжиг оловянистых бронз, имеющих после литья неоднородное строение вследствие ликвации. Наоборот, нагрев сплавов, приводящий к распаду пересыщенного твердого раствора и выделению частиц второй фазы, снижает коррозионную стойкость. Разность потенциалов отдельных составляющих микроструктуры способствует электрохимической коррозии.
В неоднородных металлах коррозия носит местный характер, охватывая отдельные анодные участки их поверхности с низким значением электродного потенциала (рис. 10.3, б). К местной коррозии относятся питтинг или точечная коррозия, пятнистая и язвенная ее разновидности. Очаги местной коррозии являются концентраторами напряжений.
Анодными участками могут быть границы зерен и фаз, в то время как сами зерна являются катодами. В этом случае развивается наиболее опасный вид коррозии — межкристаллитная коррозия (МКК). Она почти незаметна с поверхности и распространяется в глубь металла по границам зерен (рис. 10.3, в). В результате межкристаллитной коррозии нарушается связь между зернами, при постукивании по металлу пропадает характерный металлический звук, и после приложения нагрузки металл легко разрушается.
Межкристаллитная коррозия высокохромистой стали обусловлена выделением при повышенных температурах по границам зерен карбидов типа (Сr,Me)23С6 или Сr23С6. Эти карбиды образуются вследствие диффузии углерода из всего объема зерна, а хрома — только с приграничных областей (рис. 10.4). Углерод перемещается по межузельному механизму диффузии (по механизму внедрения), который по сравнению с перемещением атомов по механизму замещения характеризуется высокой подвижностью. Это приводит к снижению содержания хрома в приграничных областях ниже его критической концентрации 12–14 % и скачкообразному падению электродного потенциала с +0,2 до –0,6 В (рис. 10.5). Границы зерен становятся анодом по отношению к металлу внутри зерен.
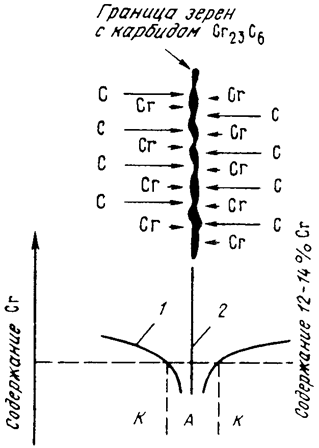
Рис. 10.4. Схема формирования межкристаллической коррозии высокохромистой стали (стрелками указаны зоны диффузии хрома и углерода):
1 — распределение хрома в граничной области;
2 – граница зерен;
А — анодная зона;
К — катодная зона
Эффективным средством, подавляющим межкристаллитную коррозию высокохромистых сталей, является максимальное снижение содержания углерода и введение в сталь таких сильных карбидообразующих элементов, как титан или ниобий, обладающих бльшим сродством к углероду, чем хром.
При одновременном действии коррозионной среды и нагрузки или остаточных напряжений возникает коррозия под напряжением, проявляющаяся в виде коррозионного растрескивания или сетки трещин. Места концентрации напряжений имеют более низкий электродный потенциал и приобретают характер анодных участков.
Из жизненных ситуаций известно, что в поврежденных местах кузовов автомобилей, а также в местах деформаций, обведенных пунктиром на рис. 10.6, продукты коррозии появляются чаще всего. Высокие остаточные напряжения являются причиной ускоренной коррозии сварных швов, околошовной зоны, болтовых, заклепочных и других соединений.
Большое влияние на процесс коррозии в водных средах оказывает растворенный в жидкости кислород. При достаточном содержании кислорода на поверхности образуется защитная оксидная пленка, повышающая электродный потенциал металла. Наиболее опасные анодные зоны создаются в местах плохой аэрации, где затруднен доступ кислорода из воздуха. Хорошо известно, что та часть стальной плиты, которая находилась под слоем песка, корродирует в большей степени по сравнению с той частью, которая оставалась под непосредственным влиянием атмосферы. Стальные гвозди в старых деревянных конструкциях разрушаются гораздо быстрее, чем их головки, расположенные снаружи. Аналогичное явление наблюдается в щелях замкнутых профилей (пример — пороги автомобилей), на стыке листов, на резьбовой поверхности в болтовых соединениях, на грязной поверхности и т. д. Примеры таких случаев представлены на рис. 10.7, а в табл. 10.1 представлены некоторые группы коррозионных пар.
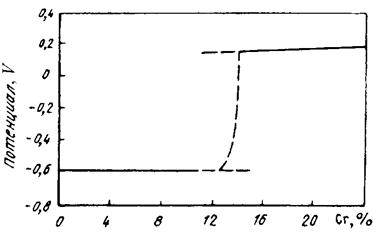
Рис. 10.5. Влияние содержания хрома на изменение электрохимического потенциала стали
Рис. 10.6. Коррозионные пары, образовавшиеся
в результате деформации:
а) согнутый пруток; б) соединение листов
Внутренние напряжения сами по себе не вызывают коррозии. Интенсифицируя это явление, они становятся инициаторами анодного процесса. Неоднородность внутренней структуры материала способствует коррозии. Коррозионные явления усиливаются при наложении анодной напряженности на структурную.
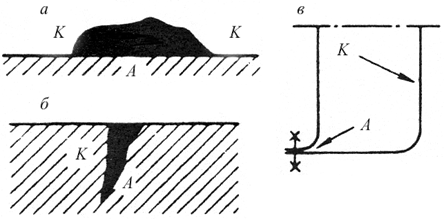
Рис. 10.7. Коррозионные пары, образовавшиеся при загрязнении поверхности стального листа (а), в устье трещины (б), в щели замкнутого профиля (в)
Таблица 10.1
Date: 2015-07-25; view: 982; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |