
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электронное строение атомов и их свойства
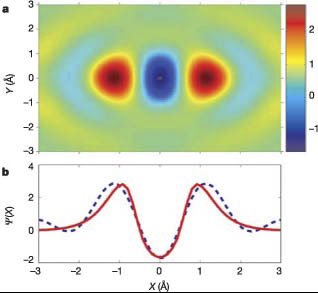 a - полученное с помощью компьютерной томографии (2004 г.)изображение молекулярной орбитали 2p s g; b - форма волновой функции вдоль межъядерной оси (штрихи - реконструкция на основании экспериментальных данных, сплошная линия - расчеты из первых принципов). a - полученное с помощью компьютерной томографии (2004 г.)изображение молекулярной орбитали 2p s g; b - форма волновой функции вдоль межъядерной оси (штрихи - реконструкция на основании экспериментальных данных, сплошная линия - расчеты из первых принципов).
|
Z = 1 (водород). В этом атоме имеется один электрон в состоянии с квантовыми числами n = 1, l = 0, ml = 0, ms = +1/2 или -1/2. Энергия ионизации Ei= 13.6 эВ. Среднее расстояние электрона от ядра составляет около 0.75·10-10 м. Об этом атоме и его свойствах - отдельная лекция.
Z = 2 (гелий). Два электрона находятся в состоянии с квантовыми числами n = 1, l = 0, ml = 0, ms = +1/2 и -1/2 (т.е. два 1s электрона). Волновые функции, описывающие их состояние, несколько отличаются от водородных по форме из-за кулоновского отталкивания электронов, но главное отличие в масштабах величин. Для иона гелия из выражения (4), где есть множитель Z2, видно, что энергия связи электрона составит 54.4 эВ. Характерное расстояние электрона от ядра составит 0.53·10-10/Z м. В атоме гелия с двумя электронами из-за их отталкивания энергия ионизации составляет 24.6 эВ (нечто среднее между 13.6 для водорода и 54.4 для He+). Это самое большая величина для всех химических элементов. Оторвать электрон у атома гелия очень трудно, и в 1s состоянии нет вакантных мест. Поэтому гелий химически инертен, не образует молекул ни содним элементом.
Z = 3 (литий). В 1s состоянии находится два электрона, и принцип Паули запрещает поместить туда третий. Этот электрон находится в состоянии с n = 2 (2s) на большем удалении от ядра и с гораздо большей энергией (т.е. существенно меньшей энергией связи). Среднее удаление электрона от ядра так велико, что в первом приближении ядро и два электрона в 1s состоянии можно рассматриватькак точечный остов с зарядом +e. Третий электрон тогда с n = 2 должен иметь энергию (формула (4)) -13.6/4 = -3.4 эВ. Действительное значение -5.4 эВ, т.е. и правда малое (приближение не слишком плохое). Малое значение энергии ионизации означает, что литий имеет очень высокую активность. Размеры и энергии атома подтверждены надежными измерениями.
Z = 4 (бериллий). Электронная конфигурация - 1s22s2. Из-за увеличения Z энергия ионизации больше, чем для лития, и составляет 9.3 эВ. Для отрыва второго электрона в состоянии n = 2 надо затратить не на много больше, поэтому в химических соединениях бериллий имеет валентность +2. 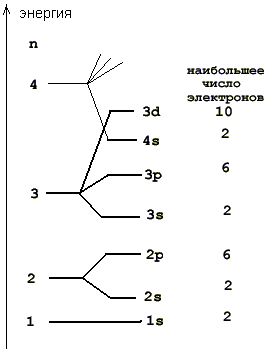
Z = 5 (бор). Электронная конфигурация - 1s22s22p1. Энергия ионизации 8.3 эВ (меньше, чем у бериллия). С одной стороны заряд ядра увеличился, с другой в 2p-состоянии энергия больше, чем в 2s. Второй фактор сильнее и, отделить электрон в 2p-состоянии легче. Валентность +3.
...
Z = 7 (азот), Z = 8 (кислород), Z = 9 (фтор). У атомов этих элементов не хватает трех, двух и одного электрона, соответственно, до заполнения оболочки с n = 2, а именно 2p состояния. Эти атомы химически электроотрицательны, т.е. в химических соединениях захватывают электроны. "Лишние" электроны оказываются связанными с ядром так же, как и остальные в 2p состоянии (хотя связь всех 2p электронов несколько меньше, чем в нейтральном атоме, из-за увеличения электрон-электронного отталкивания).
Z = 10 (неон). Все 10 возможных состояний с n = 1 и n = 2 заняты. Электронная конфигурация - 1s22s22p6. Энергия ионизации, пости непрерывно возраставшая, начиная с лития, составляет 21.6 эВ. Оторвать электрон трудно, и добавить тоже, т.к. дополнительный электрон должен был бы находиться в состоянии с n = 3 на большом удалении от ядра. Подобно гелию неон химически весьма инертен.
В элементах с Z = 11 (натрий) по Z = 18 (аргон) заполняются состояния 3s и 3p и по химическим свойствам они схожи с соответствующими элементами второго ряда (литий - неон).
Z = 19 (калий) и Z = 20 (кальций). Можно было бы ожидать, что начнется заполнение состояния 3d (l=2), но энергия электрона в состоянии 4s ниже, чем в 3d (см. схему уровней), и в обоих атомах последние электроны оказываются в 4s состоянии. Электронные конфигурации атомов - 1s22s22p63s23p64s1 и 1s22s22p63s23p64s2.
...
Далее следует заполнение состояний 3d, 4p,.... Иногда оказывается энергетически более выгодным оказаться электрону не в 4s состоянии, а в 3d. Например, у атома меди (Z = 29) конфигурация 1s22s22p63s23p63d104s1, хотя у предшествуюшего атома никеля (Z = 28) 1s22s22p63s23p63d84s2.
Не будем далее продолжать перечень элементов (подробно порядок заполнения электронных оболочек описан в приведенной ниже литературе и наглядно демонстрируется в простой модели). Рассмотренные примеры показывают, что квантовая механика на основе электронных структур атомов удовлетворительно описывает все основные закономерности периодической системы элементов Менделеева.
Подведем итоги:
· основываясь на соотношении неопределенности, можно получить разумные оценки энергии основного состояния и размера многоэлектронных атомов;
· состояние электрона в атоме задается значением четырех квантовых чисел: главного n, орбитального l, магнитного m и проекции спина ms;
· два принципа: Паули и минимума энергии лежат в основе заполнения электронных состояний;
· атомы действительно имеют те свойства, что следуют из предсказанных квантовой механикой электронных конфигураций.
· Квантовые числа электрона
· Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He +, Li 2+ и т. д.). В этом случае энергия электрона
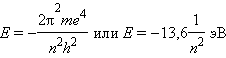
|
· n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном.
· В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
| Модель 2.2. Атом водорода. |
· Орбитальное квантовое числоl характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых l имеет буквенные обозначения
| l | = | … | |||||
| l | = | s | p | d | f | g | … |
· Электроны с одинаковым значением l образуют подуровень.
· Квантовое число l определяет квантование орбитального момента количества движения электрона 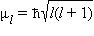 в сферически симметричном кулоновском поле ядра.
в сферически симметричном кулоновском поле ядра.
· Квантовое число m l называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от – l до + l через нуль, то есть 2 l + 1 значений. Расположение орбитали характеризуется значением проекции вектора орбитального момента количества движения M z на какую-либо ось координат (обычно ось z):
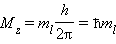
|
· Все вышесказанное можно представить таблицей:
| ||||||||||||||||||
| Таблица 2.1. Число орбиталей на энергетических подуровнях. |
· Орбитали одного подуровня (l = const) имеют одинаковую энергию. Такое состояние называют вырожденным по энергии. Так p -орбиталь – трехкратно, d – пятикратно, а f – семикратно вырождены.
· Граничные поверхности s -, p -, d -, f - орбиталей показаны на рис. 2.1.
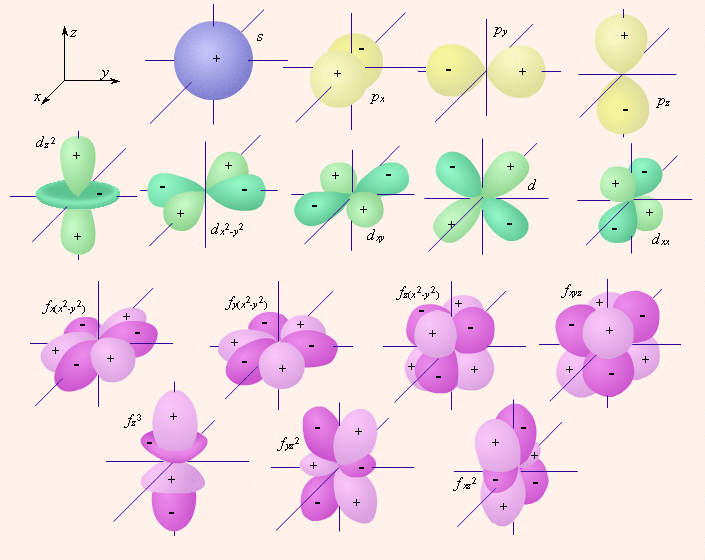
|
| Рисунок 2.1. Изображение с помощью граничных поверхностей s -, p -, d - и f -орбиталей. |
· s -Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально симметричная форма обусловлена тем, что при l = 0 и μ l = 0.
· p -Орбитали существуют при n ≥ 2 и l = 1, поэтому возможны три варианта ориентации в пространстве: m l = –1, 0, +1. Все p-орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 90° друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются p x, p y, p z.
· d -Орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором m l = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве. d -Орбитали, ориентированные лопастями по осям координат, обозначаются d z ² и d x ²– y ², а ориентированные лопастями по биссектрисам координатных углов – d xy, d yz, d xz.
· Семь f -орбиталей, соответствующих l = 3 (n ≥ 4), изображаются в виде граничных поверхностей, приведенных на рис. 2.1.
· Квантовые числа n, l и m l не полностью характеризуют состояние электрона в атоме. Экспериментально установленно, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое числоm s имеет только два значения m s = ±1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Электроны с разными m s обозначаются стрелками, направленными вверх  и вниз
и вниз  .
.
· В многоэлектронных атомах, как и в атоме водорода, состояние электрона определяется значениями тех же четырех квантовых чисел, однако в этом случае электрон находится не только в поле ядра, но и в поле других электронов. Поэтому энергия в многоэлектронных атомах определяется не только главным, но и орбитальным квантовым числом, а вернее их суммой: энергия атомных орбиталей возрастает по мере увеличения суммы n + l; при одинаковой сумме сначала заполняется уровень с меньшим n и большим l. Энергия атомных орбиталей возрастает согласно ряду
| 1 s < 2 s < 2 p < 3 s < 3 p < 4 s ≈ 3 d < 4 p < 5 s ≈ 4 d < 5 p < 6 s ≈ 4 f ≈ 5 d < 6 p < 7 s ≈ 5 f ≈ 6 d < 7 p. |
· Итак, четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.
· Главное квантовое число n в значительной степени определяет значение энергии электрона в атоме и размеры электронного облака. Оно принимает положительные целочисленные значения от 1 до бесконечности. С ростом n возрастают размеры электронного облака и энергия электронов. Вспомните, в теории Бора энергия электрона пропорциональна  !
!
· Кроме цифрового обозначения n используется и буквенная индексация:
· n = 1, 2, 3, 4 …
· K, L, M, N …
· Совокупность электронов, характеризующихся одним и тем же значением главного квантового числа, называют электронным слоем (школьное название – электронный уровень). Соответственно говорят о первом или K-слое, втором или L-слое, третьем или M-слое и т.д.
· Второе квантовое число (ℓ), называемое орбитальным (побочным, в иностранной литературе – азимутальным) квантовым числом, характеризует энергию электрона внутри слоя (уровня) и определяет форму электронного облака. Оно принимает положительные целочисленные значения, начиная с нуля, но имеет ограничение: при данном значении главного квантового числа n величина ℓ не может превысить значение (n–1). На практике побочное квантовое число чаще обозначается буквами:
· ℓ = 0, 1, 2, 3, 4,…, n–1
· s, p, d, f, g,…
· Совокупность электронов c одним и тем же значением побочного квантового числа называют электронной оболочкой (подуровнем). Соответственно говорят об s-, p-, d-, f- и т. д. оболочках.
· Третье квантовое число (mℓ), называемое магнитным, определяет ориентацию орбитали в пространстве. Орбиталь же образуется совокупностью электронов с одним и тем же значением магнитного квантового числа, её традиционно обозначают клеточкой ٱ (квантовая ячейка). При данном значении ℓ, магнитное квантовое число принимает значения:
· 1, 2, 3, 4, …, ℓ
· mℓ = 0
· –1, –2, –3, –4, …, –ℓ
· Общее число значений составляет (2ℓ+1).
· Названные три квантовых числа непосредственно вытекают из решения уравнения Шредингера в трёхмерном мире. У электрона есть и четвертая квантовая характеристика – спиновое квантовое число ms, отражающее четвёртую координату нашего мира – время. Спиновое квантовое число принимает (в единицах атомного мира) лишь два значения: +½ и –½. Договоримся считать значение +½ больше значения –½ и будем обозначать электроны со спином +½ стрелочкой , а электроны со спином –½ – стрелочкой ¯.
· Четыре квантовых числа есть полная и однозначная характеристика состояния электрона в атоме. Более того, в атоме не может быть двух электронов с одинаковым набором четырёх квантовых чисел (принцип Паули). Это – основной закон мира электронов. Принцип Паули позволяет рассчитать максимальное число электронов в слое, оболочке и на орбитали.
· 


 Орбиталь характеризуется постоянным значением mℓ. Это возможно лишь при известном значении ℓ, что в свою очередь требует постоянства значения n. Таким образом, для орбитали изменяется только спиновое квантовое число, отсюда следует, что на орбитали может быть максимально два электрона и они в соответствии с принципом Паули обязательно должны иметь противоположные спины: ¯.
Орбиталь характеризуется постоянным значением mℓ. Это возможно лишь при известном значении ℓ, что в свою очередь требует постоянства значения n. Таким образом, для орбитали изменяется только спиновое квантовое число, отсюда следует, что на орбитали может быть максимально два электрона и они в соответствии с принципом Паули обязательно должны иметь противоположные спины: ¯.
· 






 Возникает вопрос, а если на орбитали находится один электрон, то каково его состояние: или ¯? Эта проблема регулируется правилом Хунда: суммарный спин электронов оболочки должен быть максимальным. Таким образом, в рамках принятых договорённостей единственный электрон на орбитали имеет спиновое квантовое число +½.
Возникает вопрос, а если на орбитали находится один электрон, то каково его состояние: или ¯? Эта проблема регулируется правилом Хунда: суммарный спин электронов оболочки должен быть максимальным. Таким образом, в рамках принятых договорённостей единственный электрон на орбитали имеет спиновое квантовое число +½.
· Оболочка характеризуется постоянным значением орбитального квантового числа, что возможно при известном значении главного квантового числа. Следовательно, для оболочки происходит изменение магнитного и спинового квантового чисел. При значении орбитального квантового числа равном ℓ число разрешённых значений магнитного квантового числа, а значит и число орбиталей в этой оболочке составляет (2ℓ+1) штук (ℓ положительных, ℓ отрицательных и ноль). Отсюда получаем, что максимальное число электронов в оболочке составит 2(2ℓ+1) или конкретно: для s-оболочки 2; для p-оболочки 6; для d-оболочки 10; для f-оболочки 14 и т.д.
·
· Наконец, для нахождения максимального числа электронов, могущих быть в данном слое, необходимо суммировать электроны всех оболочек этого слоя. Для слоя с главным квантовым числом n это будут оболочки с ℓ =0, 1, 2, 3, …, n –1. Следовательно, ёмкость слоя составит:
· 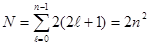
· Методом математической индукции легко показать, что эта сумма равна 2n2. Отсюда максимальное число электронов составит: в первом слое (К-слое) 2; во втором слое (L-слое) 8; в третьем слое (М-слое) 18 и т.д.
· Энергия электрона в атоме водорода (теория Бора) определяется единственным (главным) квантовым числом, а в многоэлектронном атоме – главным и орбитальным квантовыми числами. В целом энергия электрона возрастает по мере роста суммы названных квантовых чисел при доминирующем значении главного квантового числа. При одинаковой сумме энергия состояния с меньшим значением главного квантового числа ниже. В соответствии с этими правилами энергетический ряд атомных орбиталей выглядит следующим образом:
· 1s < 2s < 2p < 3s< 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s <
· < 4f < 5d < 6p < 7s < 5f < 6d < 7p …
· Для изображения атомных орбиталей используют значения волновой функции или её квадрата (точнее угловой части этой функции). Поскольку электронная орбиталь в принципе распространяется до бесконечности, то изображают её часть (например, 80 или 90%). На рис. 1.5 представлены формы 1s-, 2p- и 3d-орбиталей.
· 1s-орбиталь сферически симметрична, знак соответствующей функции одинаков в разных частях системы координат. Три 2p-орбитали представляют собой объёмные гантелеобразные фигуры, прошитые соответствующими осями координат. Четыре из пяти 3d-орбиталей представляют собой двугантельные образования, различно ориентированные в пространстве. Знаки соответствующих функций для гантелей различны. Пятая 3d-орбиталь представляет собой массивную гантель, насаженную на ось z, и тороидальную катушку в плоскости xy.
· Узловой поверхностью орбитали называют геометрическое место точек, где Ψ=0 (Ψ2=0). Узловые поверхности могут быть сферическими, плоскими и коническими. По определению каждая орбиталь имеет сферическую узловую поверхность с бесконечным радиусом.
· Главное квантовое число равно общему числу узловых поверхностей данной орбитали. Например, любая из 3d-орбиталей имеет одну сферическую узловую поверхность и две плоские (две конические – для  ).
).
· Побочное квантовое число равно числу узловых поверхностей орбитали, проходящих через начало координат. Например, любая из пяти
· 
· 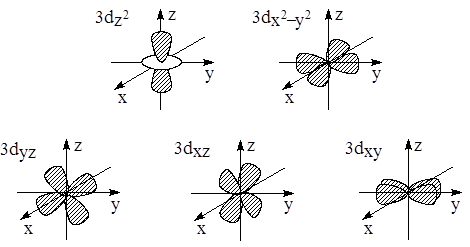
·
· Рис. 1.5. Формы 1s, 2p и 3d-орбиталей
·
· 3d-орбиталей (ℓ=2) имеет по две узловые поверхности, проходящие через начало координат.
· Отметим, что формы ns-орбиталей отличаются от формы 1s-орбитали, аналогично np-орбитали отличны от 2р-орбиталей. Однако при качественном рассмотрении вопросов химической связи, связанных с перекрыванием орбиталей, в определённом приближении можно считать любую s-орбиталь сферически симметричной, а любую р-орбиталь – гантелеподобной.
Date: 2015-07-22; view: 1053; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |