
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретическая часть. Кислотно-каталитическое разложение гидроперекиси изопропилбензола (гидропероксида кумила) лежит в основе одного из самых крупнотоннажных производств
Кислотно-каталитическое разложение гидроперекиси изопропилбензола (гидропероксида кумила) лежит в основе одного из самых крупнотоннажных производств нефтехимического синтеза ― получения фенола и ацетона по реакции:
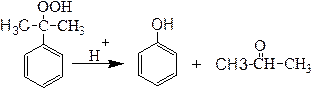
Суммарная мощность установок производства фенола и ацетона к концу ХХ века превысила 5 млн т /год.
В кинетическом отношении реакция характеризуется очень высокой скоростью, причем практически полное превращение в присутствии 0,05 ÷ 1% (масс.) Н2SO4 (в расчете на ГП ИПБ) при 50 - 60°С достигается за 2-3 мин. Реакция тормозится водой и ускоряется образующимся фенолом, имея первые порядки по кислотному катализатору и ГП ИПБ. Вместо серной кислоты в качестве катализаторов испытывались катионобменные смолы, но сведения об их практическом применении отсутствуют.
Существенное влияние на кинетику процесса оказывает среда, в которой она осуществляется. Скорость кислотного разложения ГП ИПБ линейно зависит от концентрации кумола.
Определение константы скорости и порядка реакции интегральным методом
Предположим, что реакция разложения ГП ИПБ является реакцией первого порядка, т.е. r = k∙с ГП ИПБ. Следует проверить наше предположение с помощью интегрального метода. При этом из уравнения действующих масс следует найти константу скорости.
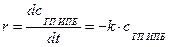 ;
;
После интегрирования левой и правой частей выражения и разделения переменных получим:
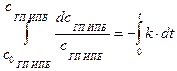 ;
;

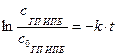
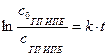 .
.
 Далее следует построить график зависимости
Далее следует построить график зависимости  от времени t. Если при этом получится прямая зависимость, то наше предположение оказалось верным и реакция является реакцией 1 порядка. Тангенс угла наклона прямой является константой скорости реакции k.
от времени t. Если при этом получится прямая зависимость, то наше предположение оказалось верным и реакция является реакцией 1 порядка. Тангенс угла наклона прямой является константой скорости реакции k.
Определение константы скорости и порядка реакции дифференциальным методом
Дифференциальный метод, предложенный Вант-Гоффом, основан на измерении скорости реакции путем определения наклона кривых, описывающих зависимости концентрации от времени.
Для реакции n-порядка можно записать уравнение действующих масс:
r = k∙c  , прологарифмируем, получим
, прологарифмируем, получим
lgr = lgk+n∙lgc
Теперь, определив скорость реакции r, моль/л∙с при различных молярных концентрациях с, моль/л реагентов и построив график зависимости lgr от lgc, можно получить уравнение прямой.
Отрезок, отсекаемый на оси ординат соответствует lgk, а тангенс угла наклона прямой tgγ ― порядку реакции n.

Этот метод применим в двух вариантах.
1.Вариант.
Основан на значении начальных скоростей, то есть концентрациях, соответствующих касательным к кривой в самом начале реакции, поскольку тангенс угла наклона касательной к кривой зависимости с, моль от t, мин tgφ соответствует скорости реакции r в данный момент времени, т. е. tgφ = r.

На графике с1, с2 и с3 соответствуют трем опытам с различными начальными концентрациями ГП ИПБ. Поскольку при измерениях изменяется начальная концентрация вещества, порядок реакции, определенный по этому способу называется концентрационным или истинным и обозначается nс.
2.Вариант.
Применяют для обработки результатов одного опыта. Метод заключается в измерении наклонов касательных к кривой зависимости с, моль/л от t, мин. в различные моменты времени, которые соответствуют различным текущим концентрациям реагента.

Поскольку при измерениях изменяется время, порядок реакции, определенный по этому способу называется временным и обозначается nt.
Определение энергии активации
Энергия активации Ea показывает, какой минимальной энергией должны обладать реагирующие частицы, чтобы они могли вступить в химическую реакцию. Энергию активации можно определить двумя методами.
1.Расчетный метод определения энергии активации Ea.
Расчетный метод определения энергии активации Ea. Величина Ea вычисляется исходя из уравнения Аррениуса: k=k0e 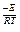 для двух различных температур Т1 и Т2.
для двух различных температур Т1 и Т2.
kT1=k0e 
kT2=k0e 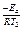
Разделим первое уравнение на второе и прологарифмируем:
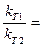
 ,
,
ln 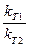 =Ea(
=Ea( -
- 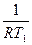 )=Ea
)=Ea  (
(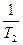 -
-  ),
),
Ea= 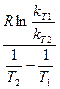 .
.
Следует учесть, что температуру T нужно перевести в размерность К, поскольку R=8,31  .
.
2.Графический метод определения энергии активации Ea.
Заключается в нахождении величины энергии активации Ea графическим путем. Прологарифмируем уравнение Аррениуса:
k = k0 ∙e 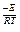 .
.
lnk = lnk0-  .
.
Построим график зависимости lnk от 1/T:

Отрезок, отсекаемый на оси ординат соответствует lnk0, а тангенс угла наклона прямой ― tgα = -  . Находим k0 и Ea = - R∙tgα
. Находим k0 и Ea = - R∙tgα
Следует учесть, что энергия активации является параметром реакции и не изменяется с изменением температуры.
Определение энтропии активации
Константа скорости, согласно теории Эйринга, выражается в виде:
k = k0∙e 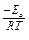 = χ
= χ  e
e  ∙e
∙e 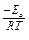 = χ
= χ  e
e  ∙e
∙e  = χе
= χе  e
e  ∙e
∙e 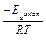 ,
,
Величина энтропии активации ΔS# находится расчетом из величины предэкспоненциального множителя k0:
k0 = χе  e
e 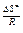
 ,
,
где K = 1,38 ∙10-23Дж/К, постоянная Больцмана;
h = 6,626 ∙10-34 Дж∙с, постоянная Планка;
K/h = 2,08 ∙1010 1/c.
χ ― трансмиссионный коэффициент — вероятность того, не каждый активированный комплекс (АК) переходит в продукты реакции. Для большинства реакций χ=1, т.е. каждый АК превращается в продукт реакции.
k0 имеет размерность 1/мин. Перевод в 1/сек:
k0' = k0/60
e 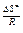 =
=  ;
;
ΔS# = R∙ln  .
.
Date: 2015-07-24; view: 1336; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |