
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Частные случаи политропного процесса
Исследуем частные политропные процессы: изохорный, изобарный, изотермический и адиабатический о точки зрения их эффективности преобразования тепла в работу.
 2.1. Изохорный процесс: v=const; dv =0 dl =0, т.е. в изохорном процессе работы не совершаются.
2.1. Изохорный процесс: v=const; dv =0 dl =0, т.е. в изохорном процессе работы не совершаются.
В рассматриваемом случае всё тепло, подводимое к рабочему телу идёт на нагрев рабочего тела, т.е.
a=1
Тогда подставив в (4.6) a = 1, получим
n= ¥
Соотношение параметров в изохорном процессе определяется законом Шарля:
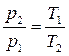 , подведённое тепло определяется зависимостью:
, подведённое тепло определяется зависимостью:

2.2. Изобарный процесс: p=const; n=0; a=1/k
Соотношение параметров в изобарном процессе определяется законом Гей-Люссака: 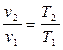
 Работа изобарного процесса определяется выражением:
Работа изобарного процесса определяется выражением:
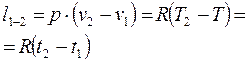
Тепло подводимое:

Изменение внутренней энергии

Для двухатомных газов, которые наиболее характерны для рабочих тел;
К = 1,4, тогда
a» 0,7; b = 1 - a» 0,3
Как видим в изобарном процессе примерно 70 % подведённого тепла идёт на нагрев рабочего тела и только 30 % на совершение работы.
Из выражения работы изобарного процесса видно, что для непрерывного преобразования тепла в работу в изобарном процессе, необходимо увеличивать v2 и T2, что в реальных условиях невозможно.
2.3. Адиабатный процесс: q1-2 = 0; dq = 0. n=k, то a=¥.
Выражение адиабатного процесса примет вид: 

Соотношение параметров в адиабатном процессе определяется полученными ранее выражениями (4-9) (4-10) и (4-11) в которых необходимо положить n=k.
Работа адиабатного процесса может быть найдена из общего выражения работы политропного процесса:
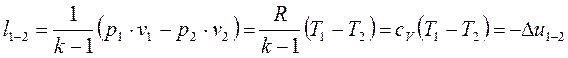
Работа в адиабатном процессе совершается за счёт уменьшения внутренней энергии рабочего тела.
Очевидно, что количество получаемой работы ограничено запасом внутренней энергии, т.е. работа не может получаться бесконечно долго.
2.4. Изотермический процесс.
Уравнение изотермического процесса: T=const; p×v=const; n=1; a = 0
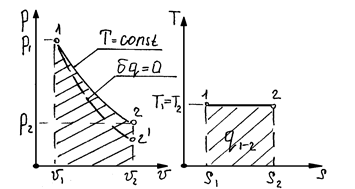 Соотношение параметров в изотермическом процессе определяется законом Бойля-Мариотта и имеет вид:
Соотношение параметров в изотермическом процессе определяется законом Бойля-Мариотта и имеет вид: 
Определить тепло или работу изотермического процесса, используя ранее полученные зависимости для политропного процесса не возможно, т.к. теплоёмкость изотермического процесса равна ¥, а в выражении для работы получается неопределённость вида: 0/0.
В изотермическом процессе, все тепло, подведённое к рабочему телу идёт на совершение работы, т.е.
 и
и 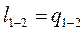
Выражение l1-2 найдём интегрируя общее выражение:
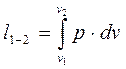 , в котором подставим р из уравнения состояния, т.е.
, в котором подставим р из уравнения состояния, т.е.
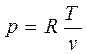 , тогда:
, тогда:

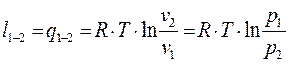
Как видно из последних выражений для непрерывного получения работы в изотермическом процессе необходимо непрерывное увеличение объёма и уменьшение давления, что в реальных условиях невозможно.
Вывод: как видно из проведённого анализа наиболее полное преобразование тепла в работу происходит в изотермическом процессе (b = 1). Однако не в одном из процессов работа не может производиться бесконечно долго.
3. Твёрдое, жидкое и газообразное состояние
вещества.  диаграмма изменения состояния
диаграмма изменения состояния
Любое вещество может находиться в З-х основных агрегатных состояниях, твёрдом, жидком и газообразном.
Если проводить нагрев твердого вещества при постоянном давлении в установке имеющей вид,
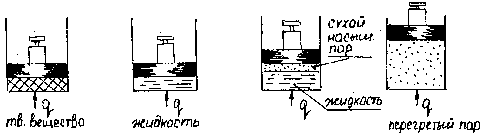
то можно наблюдать все 3 агрегатных состояния. По мере прогрева твердого вещества при постоянном давлении, меняется его температура до тех пор, пока не начнется превращение твёрдого вещества в жидкое.
При дальнейшем подводе тепла идёт превращение твердого вещества в жидкое, при этом температура не меняется.
После превращения всего вещества в жидкость при подводе тепла растет температура жидкости, до тех пор, пока не начнется превращение жидкости в газ (пар). При фазовом превращении жидкости в газообразное состояние, при неизменном давлении температура также не меняется.
Температура и давление при которых жидкость превращается в газ носит название температуры и давления насыщения (кипения).
Температура и давление насыщения каждого вещества связаны зависимостью, графическое изображение которой носит название линии насыщения. Для большинства веществ она имеет вид:
Процесс фазового превращения жидкости в газ сопровождается обязательным подводом тепла, которое может быть характеризовано теплотой парообразования  .
.
Определение:
Теплота парообразования численно равна количеству тепла, которое необходимо подвести к 1кг жидкости, чтобы превратить его в пар при постоянном давлении (температуре) насыщения.
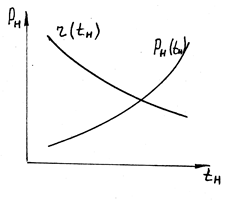
С ростом давления насыщения теплота парообразования уменьшается.
Изменение состояния вещества во всём диапазоне температур м.б., описана уравнением Боголюбова-Майера, использование которого требует наличие вычислительной техники. В инженерной практике часто используют диаграммы состояния, подученные обработкой экспериментальных данных на установках аналогичных рассмотренной.
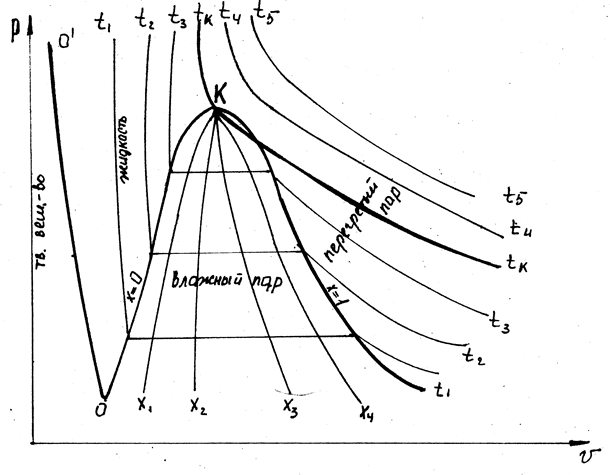
На основании полученных измерений отроят  диаграмму состояния, имеющую вид
диаграмму состояния, имеющую вид
 - изотерма соответствующая температуре плавления, которая отделяет на диаграмме область твёрдого и жидкого состояния.
- изотерма соответствующая температуре плавления, которая отделяет на диаграмме область твёрдого и жидкого состояния.
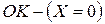 - линия, отделяющая область жидкого состояния от области влажного пара.
- линия, отделяющая область жидкого состояния от области влажного пара.
Под влажным паром понимают совокупность газообразного вещества и капельной живости.
Влажный пар характеризуется степенью сухости пара  , где
, где
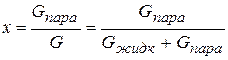 (4.16)
(4.16)
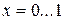
Изотерма проходящая через (•) 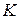 , носит название критической изотермы. При температуре выше критической, вещество не может существовать в жидком и твёрдом состоянии.
, носит название критической изотермы. При температуре выше критической, вещество не может существовать в жидком и твёрдом состоянии.
Точка 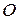 носит название тройной точки. При данных условиях вещество может существовать во всех 3-х агрегатных состояниях.
носит название тройной точки. При данных условиях вещество может существовать во всех 3-х агрегатных состояниях.
Date: 2015-07-24; view: 785; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |