
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химизм реакций горения
Горение – это экзотермическая окислительная реакция соединения горючего вещества с окислителем – кислородом воздуха.
Горючие вещества - газы, жидкости и твердые тела. Это Н2, СО, сера, фосфор, металлы, СmHn (углеводороды в виде газов, жидкостей и твердых веществ, т.е. органические вещества. Природными углеводородами, например, являются природный газ, нефть, уголь). В принципе, горючими могут все вещества, способные к окислению.
Окислители - кислород, озон, галогены (F, Cl, Br, J), закись азота (NO2), аммиачная селитра (NH4NO3) и др. У металлов - СО2, Н2О, N2.
Горение при реакциях разложения веществ, полученных в эндотермических процессах. Например, при распаде ацетилена:
С2Н2 = 2С + Н2.
Экзотермические реакции – это реакции, проходящие с выделением тепла.
Эндотермические реакции – это реакции, проходящие с поглощением тепла.
Например:
2Н2+О2=2Н2О+Q – экзотермическая реакция,
2Н2О+Q=2Н2+О2 – эндотермическая реакция,
где: Q – тепловая энергия.
Стехиометрические составы:
α=1- стехиометрический компонент;
α>1- с избытком воздуха;
α<1- с избытком топлива.
α=1,2;…;1,25 – оптимальное.
Если смесь стехиометрическая, то Т=max;
Если α>1– смесь называется бедная или кислая;
Если α<1– смесь называется богатой или сладкой.
СН4 + 2О2 = СО2 + 2Н2О
1 моль СН4 + 2 моля О2 = 1 моль СО2 + 2 моля Н2О.
33,3% СН4 и 2/3=66,7% О2.
Горение СН4 в воздухе, т.е. в смеси 21% О2+79% N2 или О2+79/21N2 или О2+3,76N2:
СН4+2О2+2×3,76N2=СО2+2Н2О+2×3,76N2.
1 моль СН4+2 моля О2+7,52 моля N2 = 10,52 моля смеси О2, N2 и СН4.
Стехиометрический состав смеси:
(1/10,52)*100%=9,5% СН4; (2/10,52)*100%=19,0% О2;
(7,52/10,52)*100%=71,5% N2.
Произвольные, нестехиометрические составы:
2СН4+2О2=СО2+2Н2О+СН4 1 моль СН4 не прореагирует.
СН4+4О2=СО2+2Н2О+2О2 2 моля О2 не участвует в реакции (балласт).
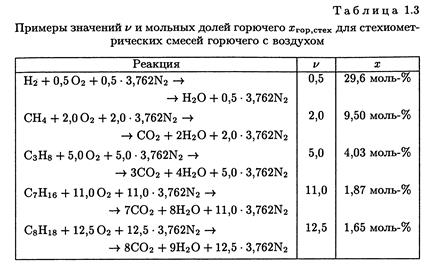
Мольная доля горючего в стехиометрической смеси может быть легко определена из соотношения
xгор,стех = 1/(1 +n)
Здесь v обозначает число молей О2 в уравнении реакции с образованием СО2 и Н2О. Примером служит реакция
Н2 + 0,5О2 —> Н2О, n = 0,5, хН2,стех = 2/3.
Если окислителем является воздух, то следует принимать во внимание, что сухой воздух содержит только 21% кислорода, а также 78% азота и 1% благородных газов. Таким образом, для воздуха xN2 = 3,762×хО2. Отсюда мольные доли для стехиометрической смеси с воздухом будут равны
xгор,стех = 1/(1 + f × 4,762), хО2,стех =n× xгор,стех, хN2,стех =3,762× хО2,стех
где v как и прежде означает количество молей О2 в уравнении реакции полного превращения одного моля горючего в СО2 и Н2О. Ряд примеров значений v и мольных долей горючего для стехиометрических смесей горючего с воздухом приведен в табл. 1.3.
Топлива и их основные характеристики
Топливо – горючее вещество, выделяющее при сжигании значительное кол-во тепла, которое используется в технологических процессах или преобразуется в др. виды энергии.
Топливо – горючее вещество, которое экономически целесообразно использовать для производства топлива.
Целесообразность тех или иных веществ в качестве топлива обосновывается технико-экономическими факторами:
-наличие больших запасов;
-стоимость добычи и транспортировки;
-реакционная способность;
-влияние на окружающую среду;
-доступность для использования.
В качестве топлива гл. образом используются органические вещества состоящие из С и Н. Топливо разделяют на природные (каменный и бурый уголь) и искусственные(бензин, мазут).
Свойства топлива определяются его составом. При этом есть 2 подхода: по молекулярному (газы) и элементарному (твёрдое и жидкое топливо) составу.
Горючая часть – СО, Н2, СН4,СnHm,Н2S.
Не горючая часть – O, N, CO2.
Date: 2015-07-24; view: 1067; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |