
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Обратимые реакции
Предположим, вещество A может превращаться в вещество B, а оно, в свою очередь, обратно переходит в вещество A. Изменение концентрации вещества A обусловлено одновременным протеканием двух реакций: распада A со скоростью k 1[A] и его образования со скоростью k 2[B]. Скорость изменения концентрации вещества A равна разности этих величин:
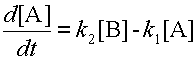
| (8) |
Надо сказать, что чем сложнее схема реакции, тем сложнее соответствующая система уравнений, и преобразования могут стать довольно громоздкими. Поэтому в дальнейшем мы наряду с распространенным обозначением концентрации будем использовать переменные в виде малых латинских букв, т.е. a вместо [A], b вместо [B] и т
Концентрацию b находим из уравнения 6 материального баланса и подставляем в уравнение 8.
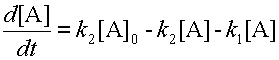
| (9) |
или, используя новые, более компактные обозначения:
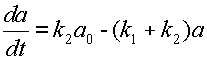
| (10) |
Произведём разделение переменных:
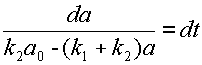
| (10) |
и интегрирование в пределах от ao до a и от 0 до t:
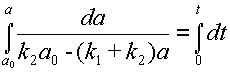 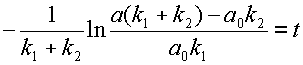
| (11) |
После преобразований получаем весьма громоздкое выражение для значения концентрации субстрата:
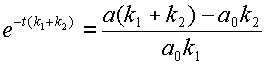 откуда
откуда 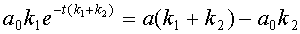
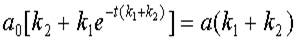
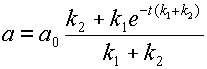 (12)
(12)
Это выражение можно несколько упростить, если ввести понятие равновесной концентрации вещества A:  при
при 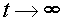 .
.
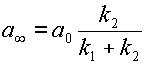
| (13) |
Из уравнения 12 получаем,
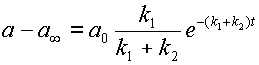
| (14) |
Что вместе с 12 дает:
С другой стророны, из уравнения 13 находим
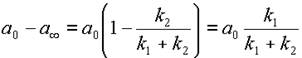
| (15) |
Разделив уравнение 14 на 15, получаем очень интересное выражение:
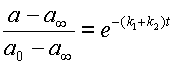
| (16) |
Откуда
На рис. 2 приведены кривые кинетики (изменения во времени концентраций) для веществ A и B в случае обратимого процесса. Анализ этих кривых, если они получены экспериментально, сразу позволяет найти отношение констант скоростей k1 / k2. Чтобы определить сами скорости, необходимо построить график в виде линейной анаморфозы (см. ниже).
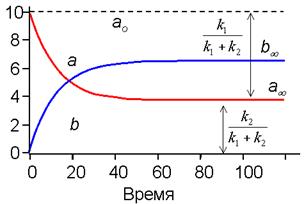
| Рис. 2. Кинетика обратимой мономолекулярной реакции По отношению отрезков ординат для a при достижении равновесия (a¥) находим соотношение констант прямой и обратной реакции. (см. уравнение 16) |
Date: 2015-07-24; view: 439; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |