
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

В2. Установите соответствие между солью и реакцией среды раствора. А Б В Г
| Соль | Среда раствора |
| А) K3PO4 | 1) Кислая |
| Б) Ba(CH3COO)2 | 2) Щелочная |
| В) Cr(NO3)3 | 3) Нейтральная |
| Г) NaNO3 |
| А | Б | В | Г |
В3. Установите соответствие между названием соли и отношением ее к гидролизу:
| Соль | Отношение к гидролизу |
| А) CH3COOK | 1) гидролиз по катиону |
| Б) NH4Cl | 2) гидролиз по аниону |
| В) Na2CO3 | 3) гидролиз по катиону и аниону |
| Г) NH4NO2 | 4) гидролизу не подвергается |
| А | Б | В | Г |
| Для задания С1 дайте полный развернутый ответ. |
С1(3 балла). Используя метод электронного баланса, составьте уравнение реакции:
KMnO4 + Na2SO3+ H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
Определите окислитель и восстановитель.
С2(4 балла). Вычислите рН раствора, в котором концентрация ионов ОН– (в моль/л) равна 5•10–6.
С3 (5 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
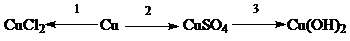
Для перехода 1 составьте электронный баланс, укажите окислитель и восстановитель.
Х–11 Контрольная работа №2 «Химические реакции» Вариант №3
| При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 2 балла за каждое верно выполненное задание. |
А1. Характеристика реакции, уравнение которой N2 + 3H2→ 2NH3:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какое количество теплоты необходимо для синтеза 67,2 л оксида азота (II). Термохимическое уравнение N2+O2 = 2NO – 90,4 кДж.
1) 45,2 кДж 2) 135,6 кДж 3) 180,8 кДж 4) 226 кДж
А3. Химическая реакция, уравнение которой: 
1) Дегидрирования 2) Изомеризации 3) Полимеризации 3) Присоединения
А4. Окислитель в реакции, уравнение которой 2Al+ Fe2О3 = Al2О3 + 2Fe + Q
1) Al0 2) Al+3 3) Fe0 4) Fe+3
А5. При повышении температуры на 30 °С (температурный коэффициент равен 2) скорость реакции увеличится в:
1) 2 раза 2) 4 раза 3) 6 раз 4) 8 раз
А6. Факторы, позволяющие сместить химическое равновесие, для реакции 2SO2(г)+O2(г)↔2SO2(г)+Q, в сторону продуктов реакции:
1) Повышение температуры и понижение давления 2) Понижение температуры и давления
3) Понижение температуры и повышение давления 4) Повышение температуры и давления
А7. Щелочную среду имеет водный раствор соли, формула которой:
1) AlCl3 2) BaCl2 3) Na2S 4) NaNO3
А8. К неэлектролитам относится:
1) ZnSO4 2) Ni(OH)2 3) H2SO4 4) Na2SO3
А9. Осадок образуется при взаимодействии сульфата цинка с:
1) AgNO3 2) NaOH 3) ZnS 4) Na2SO4
А10. Гидролизу не подвергается:
1) CuSO4 2) NaNO3 3) Na2SO3 4) (NH4)2CO3
| В заданиях В1-В3 установите соответствие. Ответ запишите в виде последовательности цифр. 4 балла за верно выполненное задание. |
В1. Установите соответствие между схемой ОВР и формулой окислителя в ней:
| Схема реакции | формула окислителя |
| А) H2S + I2 = S + 2HI | 1) NO2 |
| Б) 2S + C = CS2 | 2) H2S |
| В) 2SO3 + 2KI = I2 + SO2 + K2SO4 | 3) HI |
| Г) 3NO2+ S = SO3 + 3NO | 4) S |
| 5) I2 | |
| 6) SO3 |
| А | Б | В | Г |
Date: 2015-07-22; view: 2985; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |