
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Сутегі атомының спектрлік сериясы
Атомдық спектрлердегі заңдылықтар Химиялық элементтердің атомдарының сызықтық спектрлері
бірдей болмайды. Кейбір элементтердің атомдық спектрі қарапайым болса, кейбіреулерінің атомдық спектрі өте күрделі болады. Мысалы, сутегінің спектрінен гелий спектрі, ал гелий спектрінен аргон спектрі, аргоннан криптон спектрі əлдеқайда күрделі. Атомдардың спектрлерін талдап зерттеу үшін, спектрлік сызықтардың толқын ұзындықтарымен салыстырма интен-сивтіктерін өте мұхият өлшеу керек. Зерттеу нəтижесінде спектрлік сызықтардың орналасуында жəне интенсивтіктерінің
~ 21 ~
өзгерулерінде де белгілі заңдылық бар екендігі байқалады. Мұндай заңдылықтар қарапайым спектрлердің құрылысында өте айқын көрінеді.
Сутегі атомының спектріндегі заңдылықтар
Қарапайым спектрлердің бірі – сутегі атомының спектрі. Өйткені сутегі атомы ең қарапайым атом. Сутегі атомының спектрінің көрінетін бөлігі мен жақын ультракүлгін бөлігінде бірнеше сызықтық спектрлер байқалады. Олардың аралықтары белгілі заңдылық пен орналасып, қысқа толқын ұзындыққа қарай жақындай түседі жəне осы бағыт бойынша олардың интенсивтігі кеміп отыратындығы байқалады. Сутегі спектрінің көзге көрінетін бөлігінде төрт сызық бар, олар:
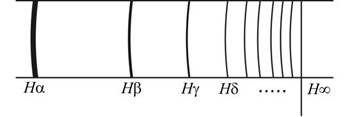
1.4-сурет
Hα(0,65628мкм), Hβ(0,4861мкм), Hδ(0,41017мкм). Олардың толқын формуламен өрнектеуге болады:
0 n 2 n 2 4

Hγ(0,43405мкм), жəне Ұзындықтарын мынадай
(1.4.1)
мұндағы, λ0 - тұрақты шама, оның сан мəні λ0=0.36456 мкм, ал n=3,4,5,6.. Осы формула бойынша есептегенде n=3 болса Hα, n=4 болса Hβ, n=5 болса Hγ, n=6 болса Hδ сызықтарының толқын ұзындығы табылады. Бұл формуланы Бальмер (Швейцариялық) тағайындаған болатын.
Бальмер формуласын түрлендіріп жазуға да болады. Егер
толқын ұзындығының орнына толқындық сан алсақ 1, онда

Бальмер формуласы былай жазылады:
~ 22 ~
| 1 1 | 1 1 | |||||||||||||||||||||
| , | R | , R | (1.4.2) | |||||||||||||||||||
| n | n | |||||||||||||||||||||
мұндағы, - спектрлік сызықтың толқындық саны, ол 1 см -ге қанша толқын ұзындық орналасатынын білдіретін сан, R = 109677,58 см-1 (Ридберг тұрақтысы).
Егер n ұмтылса R 4 болады.

Сутегі атомының спектрінде Бальмер сериясына жатпайтын сызықтар да бар. Олар бірнеше сериялар құрайды(1.5-1.6-сурет). Сутегі атомының спектрінің қашық ультракүлгін бөлігінде бір топ сызықтар Лайман сериясы деп аталады, ол
| R | ||||||||||||||||
| n | (1.4.3) | |||||||||||||||
| n=2,3,4..., m=1 | ||||||||||||||||
| Ал сутегі спектрінің жақын инфрақызыл бөлігінде Пашен | ||||||||||||||||
| сериясы деп аталатын бір топ сызық бар, ол | ||||||||||||||||
| R | ||||||||||||||||
| 32 | n 2 | (1.4.4) | ||||||||||||||
| n=4,5,6..., m=3 | ||||||||||||||||
| Ал алыс инфрақызыл алқабында Бреккет (1.4.5), Пфунда | ||||||||||||||||
| (1.4.6) сериялары бар. Олар: | ||||||||||||||||
| R | (1.4.5) | |||||||||||||||
| 42 | n 2 n=4,5,7..., m=4 | |||||||||||||||
| R | n=6,7,8..., m=5 | (1.4.6) | ||||||||||||||
| 52 | n 2 |
Осы сериялар бір-біріне өте ұқсас. Сондықтанда олардың барлығын қамтитын, мынадай универсал формула жазуға болады:
| R | ||||||
| n 2 | (1.4.7) | |||||
| m 2 | n=m+1; m+2; m+3... |
– бұл Бальмердің біріккен əмбебап формуласы деп аталады.
~ 23 ~
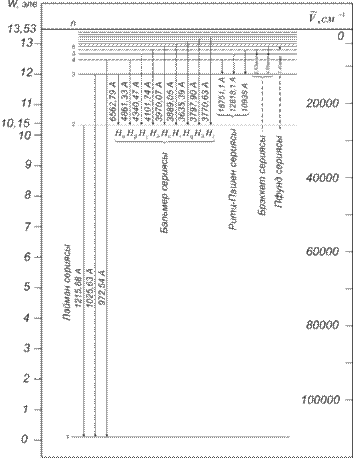
1.5-сурет
Осы серияларды энергетикалық деңгейлер арқылы қарастырсақ (1.4.7) теңдіктегі mR 2 T m; nR 2 T (n) деп белгілесек, онда спектрлік термдердің айырымдары.


| T m T n | (1.4.8) |
Энергетикалық деңгейлерді тербеліс жиілігі бойынша қарастырсақ
~ 24 ~
En Em hc

En Em E n Em hc hc hc


T m Ehcm; T n Ehcn;


(1.4.9)
(1.4.10)
– бұл сутегі атомының стационар күйдегі энергиясы. Толқындықсанды, яғни (1.4.7) мен (1.4.10) формулалардан:


немесе
| (1.4.11) | ||||
| n=1,2,3… бүтін сан | (1.4.12) |


– бұл сутегі атомының стационар күйдегі энергиясы, кез келген химиялық элементтер үшін толқындық санды мынадай түрде жаза аламыз:
1 1


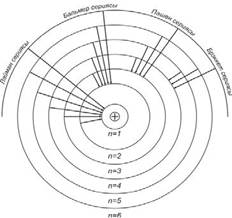
1.6-сурет
Мұндағы Z – химиялық элементтің реттік саны.
~ 25 ~
Date: 2015-07-24; view: 3134; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |