
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Прилади та реактиви
1. Прилади: гальванічний елемент, електролізери з графітовим та мідним електродами. 2. Речовини: метали магній, залізо, цинк, мідь. 3. Розчини: хлоридна кислота(2N), купрум(ІІ) сульфат, цинк сульфат, плюмбум(ІІ) нітрат, нікол(ІІ) сульфат, калій йодид, розчин крохмалю.
6.4 Вказівки з техніки безпеки
1. Дотримуватися правил роботи з розчинами кислот та солей
2. При роботі з електролізером дотримуватися наступних правил: – вмикати і вимикати випрямляч струму лише після перевірки викладачем правильності приєднання електродів до клем випрямляча;
– виймати та занурювати електроди до електролізу дозволяється лише при вимкнутому випрямлячі струму.
6.5 Порядок проведення лабораторної роботи
Дослід 1. Витиснення водню із кислот металами
У чотири пробірки налити по 4-5 крапель 2N розчину хлоридної кислоти і помістити в них по шматочку магнію, цинку, заліза і міді. Які з цих металів витісняють водень із кислоти? Написати рівняння реакцій в молекулярному та йонному вигляді. Показати в кожному випадку перехід електронів. Назвати окисник та відновник.
| Mg + HCl → | Fe + HCl → |
| Zn + HCl → | Cu + HCl → |
Дослід 2. Визначення різної електричної активності металів.
Налити у пробірки по 5-6 крапель розчинів солей: купрум(ІІ) сульфату, цинк сульфату, плюмбум(ІІ) нітрату, нікол(ІІ) сульфату. Занурити в кожну пробірку залізну пластинку. Яке явище має місце? Із розчинів яких солей залізо витісняє метал? Написати рівняння в молекулярній та йонній формах. Назвати окисник та відновник.
| CuSO4 + Fe → | Pb(NO3)2 + Fe → |
| ZnSO4 + Fe → | NiSO4 + Fe → |
Дослід 3. Виготовлення мідно-цинкового гальванічного елементу (елементу Якобі-Даніеля)
В одну склянку налити 1М розчину цинк сульфату і занурити в нього цинкову пластинку, в другу склянку налити 1М розчину купрум(ІІ)сульфату і занурити мідну пластинку. Обидва напівелементи поставити на підставку і з’єднати розчини електролітичним місточком, наповненим насиченим розчином калій хлориду в суміші з агар-агаром. Зовнішнім провідником з’єднати занурені в електроліти металічні пластинки з гальванометром. Спостерігати відхилення стрілки гальванометра, що свідчить про виникнення електричного струму. Написати рівняння реакцій, які мають місце на електродах, і сумарне рівняння окисно-відновного процесу, внаслідок якого виникає електричний струм в даному гальванічному елементі. Написати схему даного гальванічного елементу і вирахувати його електрорушійну силу (ЕРС).
Дослід 4. Електроліз водного розчину електроліту з нерозчинним анодом
Дослід провести в електролізері, який являє собою U-подібну скляну трубку висотою 10-12 см; електродами служать графітові стержні. Постійний струм одержати із змінного за допомогою випрямляча.
Налити в електролізер розчину станум(ІІ) хлориду, занурити в обидва коліна графітові електроди, і з’єднати їх провідниками з полюсами випрямляча. Через 2-4 хвилини спостерігати на катоді утворення блискучих кристалів металічного олова. Після цього вийняти графітовий анод і в анодний простір прилити по 3-4 краплі розчину Калій йодиду і крохмалю. Спостерігати появу синього забарвлення розчину електроліту. Які процеси мають місце на катоді, на аноді? Чому з’явилось синє забарвлення розчину в анодному просторі при введені калій йодиду та крохмалю?
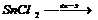 ; 2KJ + Cl2 —→
; 2KJ + Cl2 —→
Дослід 5. Електроліз водних розчинів електролітів з розчинним анодом
Налити в електролізер розчину купрум(ІІ)сульфату. Опустити в одно коліно електролізеру графітовий електрод і з’єднати його з катодом випрямляча. В друге коліно занурити мідний електрод, який буде правити за анод, з’єднати його з додатнім полюсом випрямляча. Через 2-3 хвилини спостерігати на графітовому катоді появу червоного нальоту міді. Написати рівняння реакцій, які мають місце на катоді та на аноді. Після цього мідний електрод зробити катодом, а графітовий з нальотом міді – анодом. Що сталося з нальотом міді? Після повного розчинення міді на аноді починає виділятися газ. Який це газ? Скласти відповідні рівняння реакцій.
6.6. Зміст звіту
6.6.1. Назва роботи.
6.6.2. Мета роботи.
6.6.3. Вивчення загальних відомостей
6.6.4. Виконання завдань для самостійного розв’язання.
6.6.5. Аналіз дослідів.
6.6.6. Висновки
Date: 2015-07-23; view: 413; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |