
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Анемии у детей раннего возраста. Причины, клинические проявления, методы диагностики, принципы лечения и профилактики. Проблемы пациента и сестринская помощь
Анатомо-физиологические особенности кожи, подкожно-жировой клетчатки, системы кроветворения у детей.
Методы исследования. Семиотика. Проблемы пациента. Хронические расстройства питания у детей раннего возраста.
Анемии у детей раннего возраста. Причины, клинические проявления, методы диагностики, принципы лечения и профилактики. Проблемы пациента и сестринская помощь.
КОЖА И ПОДКОЖНАЯ КЛЕТЧАТКА
Кожа
Кожа состоит из двух основных слоев: эпидермиса и дермы.
Толщина эпидермиса у новорожденных и детей раннего возраста на различных участках тела колеблется от 0,15 до 0,25 мм, в то время как у взрослого от 0,25 до 0.36 мм. Из всех слоев эпидермиса наибольшие особенности у детей имеют базальный, зернистый и роговой.
Базальный слой у новорожденных выражен хорошо и представлен двумя видами клеток: базальными и меланоцитами. Вследствие недостаточного образования меланина в последних кожа у новорожденных может быть вначале более светлой; у новорожденных африканцев она имеет красноватый цвет.
Зернистый слой у детей выражен слабо, чем и объясняется значительная прозрачность кожи новорожденных и детей первых месяцев жизни, а также ее розовый цвет. У новорожденных и грудных детей сквозь прозрачный роговой слой и слабо заметный шиповатый виден цвет крови в капиллярах. В клетках зернистого слоя у новорожденных отсутствует кератогиалин - вещество, придающее белую окраску коже.
Роговой слой у новорожденных тонок и в отличие от такового взрослых состоит из 2-3 рядов ороговевших клеток, но структура клеток эпидермиса у детей более рыхлая, содержит больше воды, что создает впечатление большей его толщины.
Граница между эпидермисом и дермой неровная, извилистая. Из-за слабого развития разделяющей их базальной мембраны при заболеваниях эпидермис легко отделяется от дермы, чем и объясняется возможное возникновение эпидермолиза — легкое образование пузырей в местах давления, на слизистых оболочках, а также при инфекциях (стрепто- и стафилодермии).
Поверхность кожи новорожденного покрыта секретом с рН, близким к нейтральному,—6,3 —5.8. Однако уже в течение первого месяца жизни величина рН существенно снижается и достигает 3,8. Это сопровождается существенным увеличением бактерицидности кожи.
Имеются существенные отличия в строении дермы у детей, которая имеет преимущественно клеточную структуру (у взрослых волокнистая структура с малым количеством клеточных элементов). Только к 6 годам гистологическое строение дермы приближается к таковому у взрослых, хотя коллагеновые волокна еще тонкие, а эластические волокна слабо развиты. Они увеличиваются к 6 годам, а максимума достигают около 35 лет.
Волосы на голове у новорожденных разной длины и цвета и не определяют дальнейшую пышность волосяного покрова.
Особенностью является замедленный рост волос в первые 2 года жизни (0,2 мм ежедневно по сравнению с 0,3 — 0,5 мм у детей старшею возраста) и быстрая их смена. Ресницы у детей растут быстро и в возрасте 3-5 лет их длина такая же, как у взрослых. (Выразительность и красота лица у детей в этом возрасте объясняется этим обстоятельством.) Толщина волос на голове существенно увеличивается с возрастом.
Ногти у доношенных новорожденных достигают дистальных окончаний последней фаланги и являются одним (менее постоянным) из критериев зрелости. В первые дни жизни наступает временная задержка роста ногтей, что проявляется появлением на ногтевой пластинке поперечной «физиологической» черты. На 3-м месяце она достигает свободного края ногтя. Это позволяет определять возраст грудного ребенка. Такое же замедление роста ногтей отмечается у детей после тяжелых заболеваний: у ногтевого ложа полоска появляется через 4 — 5 нед от начала болезни, а у края ногтя — через 4 — 5 мес. т. е. по ее появлению можно судить о сроке перенесения того или иного заболевания. При белково-калорийной недостаточности питания может появляться двусторонняя ложковидная деформация ногтей — койлонихия.
Сальные железы распространены по всей коже, за исключением ладоней и подошв. Они полностью оформляются морфологически и начинают функционировать уже на VII месяце внутриутробного периода и гистологически не отличаются от структуры у взрослых. Сальные железы у новорожденных могут перерождаться в кисты, особенно на коже носа и на соседних участках ища, образуя мелкие бело-желтые образования (milia). Они могут быть поверхностными и исчезают вместе с родовой смазкой или могут распо-лагаться под роговым слоем кожи. На волосистой части головы за счет их повышенной секреции могут образовываться «молочные корки».
Количество потовых желез к рождению ребенка такое же, как у взрослого человека. Поэтому по мере роста поверхности тела число потовых желез на единицу поверхности прогрессивно уменьшается. Так, если в первые дни жизни число эккринных потовых желез на 1 см2 поверхности тела составляем более 1000, то к концу первого года жизни — 550 —500, а к 15 годам — 200, у взрослого человека — 150. Вместе с тем морфологическое формирование эккринных желез к рождению далеко не заканчивается. Недоразвитыми оказываются выводящие протоки потовых желез, с чем связано несовершенство потоотделения. Формирование выводящих протоков потовых желез частично отмечается уже на 5-м месяце жизни, а полностью заканчивается только мосле 7 лет. Раньше завершается формирование потовых желез на лбу и голове. При этом нередко возникает усиленное потоотделение, сопровождающееся беспокойством ребенка и облысением (обтиранием) затылка. Позднее возникает потоотделение на коже груди и спины. Темпы становления функции потоотделения наиболее высоки на первом и втором месяцах жизни. Расчеты показывают, что у двухнедельного ребенка на 1 кг массы тела с кожи испаряемся за сутки 25 г воды, в возрасте 1 мес — 30 — 36 г, а к концу 1-го года жизни — 40 —50 г. По мере созревания структуры потовых желез и вегетативной нервной системы меняется и порог потоотделения. Так, двухнедельный ребенок начинает потеть при температуре воздуха 35 С, а ребенок в возрасте 2½ мес — при 27 — 28 С. Адекватность потоотделения, т. е. соответствие его направлению смены температуры воздуха, складывается в течение первых 7 лет жизни. Маленькие дети нередко отвечают потоотделением на снижение температуры окружающего воздуха и, как правило, неспособны тормозить потоотделение при понижении температуры. Апокринные потовые железы у детей раннего возраста вообще не функционируют. Начало их активности выявляется только около 8—10 лет.
В момент рождения ребенка кожа его покрыта довольно толстым слоем сыровидной смазки (vernix caseosa). Иногда она очень обильна, что, видимо, связано с конституциональными особенностями ребенка. Сыровидная смазка состоит из жира, холестерина, в ней много гликогена. Она содержит также слущивающийся эпидермис (питательная среда для микроорганизмов). Избыток ее удаляют. После снятия смазки и очищения кожи от случайных загрязнений при прохождении через родовые пути кожа новорожденного несколько отечна, бледна.
Первоначальная бледность затем сменяется реактивной краснотой с несколько цианотичным оттенком — физиологический катар кожи новорожденных (erithema neonatorum); у недоношенных детей физиологический катар кожи выражен особенно резко. Краснота достигает максимума в течение 1—2-го дня жизни, а затем сменяется мелким шелушением эпидермиса, что обычно совпадает с появлением некоторой желтушности кожных покровов и склер (физиологическая желтуха новорожденных — icterus neonatorum) у 80%, детей. Желтушная окраска кожи достигает наибольшей интенсивности на 2 —3-й день жизни и обычно к 7 — 10-му дню исчезает. Иногда желтушность покровов затягивается до 3 — 4 нед, что сравнительно часто бывает у недоношенных детей. Затянувшаяся желтуха у доношенного ребенка всегда вызывает сомнение в ее физиологичности и требует дополнительного исследования. Она может быть проявлением иммунологического конфликта при несовместимости крови матери и плода по Rh- или АВО-системам, проявлением гипотиреоза, врожденного гепатита, гемолитической анемии, сепсиса, атрезии желчных путей.
Развитие физиологической желтухи новорожденных связано с повышенным разрушением эритроцитов и незрелостью ферментных систем печени — дефицитом глюкуронилтрансферазы, превращающей свободный билирубин крови в растворимый билирубин.
Физиологическая роль кожи велика. Кожа представляет собой защитный орган благодаря своей прочности и способности выдерживать растяжение, давление, сжатие. У детей эта функция выражена значительно слабее. Об этом говорит и более легкая ранимость кожи, частая инфицируемость, что связано с недостаточной кератинизацией рогового слоя, его тонкостью, а также незрелостью местного иммунитета. Поверхность детской кожи суше, чем у взрослых, имеет более выраженную склонность к шелушению вследствие физиологического паракератоза и более слабого функционирования железистого аппарата кожи.
Указанные особенности делают детскую кожу легко ранимой и склонной к воспалениям; они же лежат в основе наиболее частых болезненных изменений кожи в этом возрасте (эритемы, опрелости, себорейный дерматит и т. д.). Склонность детской кожи к мацерации, легкая инфицируемость ее, богатство водой, обильное кровоснабжение обусловливают своеобразные проявления кожных симптомов, например сочный характер сыпи при детских инфекционных болезнях.
Кожа — орган дыхания. Интенсивность кожного дыхания у детей очень велика. По данным В. И. Молчанова, эта функция кожи у новорожденного выражена в 8 раз сильнее, чем у взрослого. Выделительная функция кожи у детей раннего возраста несовершенна. Потовые железы у них функционально развиты недостаточно. Регуляция температуры тела кожей (около 80% теплоотдачи) несовершенна у новорожденных и у детей первых месяцев жизни, что связано с большей поверхностью тела, хорошо развитой сетью сосудов, в связи с чем дети предрасположены к перегреванию и охлаждению. Сильнее выражено у детей и непосредственное испарение.
Резорбционная функция кожи у детей повышена (тонкость рогового слоя, обилие сосудов). На этом основано противопоказание к применению некоторых веществ в мазях, кремах, пастах. Опасно применение мазей, изготовленных из веществ, обладающих токсическим действием, например желтой ртутной мази, накопление которой может вызвать поражение печени, почек, сердечно-сосудистую недостаточность.
Кожа является сложным органом чувств. В ней заложены многочисленные и разнообразные рецепторы, воспринимающие раздражения, идущие извне, поэтому кожа играет исключительную роль в процессе приспособления новорождённых к условиям внешней среды.
Кожа является местом образования ферментов, витаминов, биологически активных веществ.
Подкожный жировой слой
Образование подкожного жирового слоя начинается на V месяце внутриутробного развития. В конце внутриутробного развития и в течение первого года жизни ребенка увеличение жировой ткани происходит главным образом за счет жировых клеток. Систематическое перекармливание детей может привести к появлению чрезмерно большого числа адипозоцитов, что служит причиной наиболее стойких и тяжелых форм ожирения. У новорожденных и грудных детей подкожная жировая ткань отличается рядом особенностей:
1. Жировые клетки мельче и содержат ядра; с течением времени жировые клетки увеличиваются в размере, а ядра, наоборот, уменьшаются.
2. Отношение подкожного жирового слоя у детей 1 года к массе тела относительно больше, чем у взрослых, что объясняет округлые формы их тела.
3. В грудной, брюшной полостях, в забрюшинном пространстве скопления жировой клетчатки почти отсутствуют. Они появляются только к 5 —7 годам и в основном в период полового созревания. Этим объясняется леткам смещаемость внутренних органов (например, почек).
4. Особенностью подкожной клетчатки у новорожденных и грудных детей является сохранение в ней участков ткани эмбрионального характера, обладающей как жиронакапливающей, так и кровообразующей функцией.
5. Наличие скоплений бурой жировой ткани является существенной особенностью подкожного жирового слоя у детей периода новорожденности и первых месяцев жизни. Этот жир интенсивно дифференцируется и накапливается начиная с 13-й недели внутриутробного развития. Гистологически клетки бурой жировой ткани отличаются от клеток белой жировой ткани многочисленностью жировых вакуолей, их малыми размерами, богатством клеток митохондриями. У доношенного новорожденного общее количество бурой жировой ткани составляет от 30 до 80 г, или 1 — 3% от всей массы тела. Наибольшие скопления находятся в задней шейной области, вокруг щитовидной и зобной желез, в аксиллярной области, супраилеоцекальной зоне и вокруг почек. Меньшие по размеру участки расположены в межлопаточном пространстве, в зонах трапециевидной и дельтовидной мышц, а также вокруг магистральных сосудов. Основной функцией бурой жировой ткани является так называемый несократительный термогенез, т. е. теплопродукция, не связанная с мышечным сокращением. Под влиянием холодового раздражения происходит выделение гормона симпатических окончаний — норэпинефрина, прямо действующего на метаболизм бурой жировой ткани. Результатом действия является гидролиз триглицеридов и окисление освобождающихся жирных кислот до углекислоты и воды со значительным освобождением тепла. Максимальная способность к теплопродукции бурой жировой ткани определяется в первые дни жизни. Запасы этой ткани у доношенного ребенка могут обеспечить защиту от умеренного охлаждения на протяжении 1—2 дней. С возрастом способность бурой жировой ткани к теплопродукции снижается. Исчезновение бурой жировой ткани происходит в течение нескольких месяцев. У детей, подвергшихся длительному охлаждению, бурая жировая ткань может полностью исчезнуть. При голодании сначала исчезнет белая жировая ткань, и только при больших сроках и степенях голодания — бурая. Поэтому у дистрофированных детей резко увеличивается склонность к охлаждению. Глубоконедоношенные дети с малым запасом бурой жировой ткани очень легко охлаждаются и нуждаются в согревании.
К рождению подкожная жировая клетчатка более развита на лице, конечностях, груди, спине. В этих областях жировой слой достигает максимального развития к 6-й неделе, на животе — к 4 —6-му месяцу. Его исчезновение в случае заболевания происходит в обратном порядке, т. е. сначала на животе, затем на конечностях и туловище, в последнюю очередь на лице.
С возрастом происходят и изменения состава жировой ткани. У новорожденного на собственно жир приходится только 35,5%, к первому году жир составляет уже 56%, а у взрослых — от 60 до 90% состава жировой ткани. Изменяются и соотношения различных компонентов самого жира.
Определение количества жира в организме имеет диагностическое значение. У детей о количестве жировой ткани судят либо исходя из соотношений длины и массы тела, либо по толщине складок кожи.
Имеются существенные различия в содержании жировой ткани у мальчиков и девочек. Особенно резко они выражены при достижении ими половой зрелости. Так, у девочек малая выраженность мышечного рельефа тела и округлость форм объясняются тем, что более 70% жировой ткани приходится на подкожный жир, в то время как у мальчиков подкожный жировой слой составляет только около 50% общей жировой массы тела.
КРОВЬ И КРОВЕТВОРЕНИЕ
Кроветворение во внутриутробном периоде начинается рано. Приблизительно к концу 3-й недели гестации в кровяных островках желточного мешка, стебле и хорионе образуются первые клетки крови – мегалобласты. К 22-му дню гестации кровяные клетки проникают в мезодерму эмбриона, формирующуюся сердечно-сосудистую систему, где также происходит образование примитивных эритробластов. Начиная с 6-й недели гестации основным органом кроветворения становится печень, причем максимума кроветворная функция печени достигает на V месяце внутриутробного развития, а затем постепенно угасает к рождению. С этого времени наряду с эритроидными клетками начинают образовываться первые нейтрофилы и мегакариоциты, при этом мегалобластический тип кроветворения сменяется на нормобластический. Такая смена эритропоэза объясняется тем, что в слизистой оболочке фундального отдела желудка к этому времени начинают функционировать добавочные клетки, которые продуцируют гастромукопротеин.
С III месяца внутриутробного развития кроветворение начинает также происходить в селезенке и прекращается к V месяцу внутриутробного развития. Лимфопоэз возникает на II месяце. На 50 —60-е сутки лимфоциты появляются в крови, вилочковой железе, селезенке, лимфатических узлах, миндалинах, групповых лимфатических фолликулах (пейеровы бляшки). Кровяные клетки моноцитарного ряда появляются на 18 —20-й день гестации.
Костный мозг закладывается в конце III месяца эмбрионального развития за счет мезенхимных периваскулярных элементов, проникающих вместе с кровеносными сосудами из периоста в костномозговую полость. С IV месяца начинается костномозговое кроветворение, которое к концу внутриутробного развития и на протяжении всего постнатального периода становится основным. Костный мозг в пренатальном периоде красный. Его объем с возрастом плода увеличивается в 2½ раза (например, на 9-й неделе объем костного мозга составляет 16 мл. а к рождению — 43 мл).
Основным отличием состава форменных элементов крови плода является постоянное нарастание числа эритроцитов, содержания гемоглобина, количества лейкоцитов. Если в первой половине внутриутробного развития (до 6 мес) в крови обнаруживается много незрелых элементов (эритробластов, миелобластов, про- и миелоцитов), то в последующие месяцы в периферической крови плода содержатся преимущественно зрелые элементы.
Изменяется и состав гемоглобина. Вначале (9—12 нед) в мегалобласюх находится примитивный гемоглобин (НbР), который заменяется фетальным (HbF). Он становится основной формой в пренатальном периоде. С 3-й недели гестации начинается синтез гемоглобина взрослого (НЬА), интенсивность образования которого увеличивается с возрастом плода. Однако к рождению фетальный гемоглобин составляет приблизительно 60 %, а взрослый – 40% всего гемоглобина эритроцитов периферической крови. Важным физиологическим свойством примитивного и фетального гемоглобинов является их более высокое сродство к кислороду, что имеет важное значение во внутриутробном периоде для обеспечения организма плода кислородом, когда оксигенация крови плода в плаценте относительно ограничена по сравнению с оксигенацией крови после рождения в связи с установлением легочного дыхания.
По современным представлениям, дифференцировка клеток крови осуществляется через ряд последовательных ступеней. Каждая следующая ступень означает возникновение клеток с меньшей степенью универсальности последующего направления развития и меньшей способностью к самоподдержанию.
Доказано существование единой полипотентной стволовой клетки, способной дифференцироваться в направлении и миелопоэза. и лимфопоэза. Следующей ступенью дифференцировки в направлении миелопоэза является возникновение клетки-предшественницы миелоидного кроветворения. Затем следует ряд бипотентных клеток. Среди них выделены предшественницы: грануломоно-, гранулоэритро-, эритромегакариоцитопоэза. После них формируются клетки уже унипотентные — гранулоцито-, эозино-. базофилопоэза и тучных клеток, эритропоэза, мегакариоцитопоэза. На последних этапах возникают уже морфологически различимые на миелограмме промежуточные и зрелые клетки всех рядов костномозгового кроветворения.
В лимфоидном ряду кроветворения пока не удалось выделить родоначальную клетку для В- и Т-лимфопоэза с универсальностью последующей дифференцировки. Получены только отдельные родоначальные клетки для двух этих направлений. По стадиям формирования лимфоцитов выделяют следующие этапы: клетки-предшественницы или пре-В- и пре-Т-лимфоциты, затем ранние В- и Т-лимфоциты и зрелые В- и Т-лимфоциты.
Интенсивность формирования клеток того или иного ряда зависит от действия гуморальных регуляторов — стимуляторов (поэтинов) или ингибиторов. Функцию лейкопоэтинов выполняют различные колониестимулирующие факторы. Ингибирование гранулоцитопоэза осуществляют лактоферрин и простатландины. Для эритроцитов стимуляторами являются эритропоэшн и бурстобразующий фактор, для тромбоцитов — тромбопоэтин, для Т-лимфоцитов -- ТИМОЗИН и Т-ростовой фактор.
Все фагоциты организма относятся к производным кроветворных клеток и являются потомством моноцитов.
У новорожденного масса костного мозга составляет примерно 1,4% массы тела (около 40 г). С возрастом увеличивается масса костного мозга и у взрослого человека составляет в среднем 3000 г.
Красный костный мозг в пренатальном периоде развития присутствует во всех костях и окружен эндостом, выстилающим костные полости. Лишь к концу гестации начинают появляться в костном мозге конечностей жировые клетки. После рождения в отдельных частях скелета красный костный мозг заменяется желтым.
Состав периферической крови в первые дни после рождения претерпевает значительные изменения. Сразу же после рождения красная кровь новорожденных характеризуется повышенным содержанием гемоглобина и большим количеством эритроцитов. В среднем сразу после рождения содержание гемоглобина равно 210 г/л (колебания 180 — 240 г/л) и эритроцитов — 6- 1012/л (колебания 7.2-1012/л — 5,38-1012/л). Через несколько часов после рождения содержание эритроцитов и гемоглобина увеличивается за счет плацентарной трансфузии и гемоконцентрации, а затем с конца первых — начала вторых суток жизни происходит снижение содержания гемоглобина (наибольшее — к 10-му дню жизни), эритроцитов (к 5 —7-му дню).
Красная кровь новорожденных отличается от крови детей более старших возрастов не только в количественном, но и в качественном отношении. Для крови новорожденного прежде всего характерен отчетливый анизоцитоз, отмечаемый в течение 5 — 7 дней, и макроцитоз, т. е. несколько больший в первые дни жизни диаметр эритроцитов, чем в более позднем возрасте.
Кровь новорожденных содержит много молодых еще не совсем зрелых форм эритроцитов, указывающих на активно протекающие процессы эритропоэза. В течение первых часов жизни количество ретикулоцитов — предшественников эритроцитов — колеблется от 8—13‰ до 42‰. Но кривая ретикулоцитоза, давая максимальный подъём в первые 24 – 48 часов жизни, в дальнейшем начинает быстро понижаться и между 5-м и 7-м днями жизни доходит до минимальных цифр. Кроме этих молодых форм эритроцитов, в крови новорожденных как вполне нормальное явление встречаются ядросодержащие формы эритроцитов, чаще нормоциты и эритробласты. В заметном количестве их удается обнаружить только в течение нескольких первых дней жизни, а затем они встречаются в крови в единичном виде.
Наличие большого числа эритроцитов, повышенное количество гемоглобина, присутствие большого количества молодых незрелых форм эритроцитов в периферической крови в первые дни жизни свидетельствуют об интенсивном эритропоэзе как реакции на недостаточность снабжения плода кислородом в период внутриутробного развития, и в родах. Эритропоэз у детей при рождении составляет около 4- 1012/л в сутки, что в 5 раз выше, чем у детей старше года и взрослых. После рождения в связи с установлением внешнего дыхания гипоксия сменяется гипероксией. Это вызывает снижение выработки эритропоэтинов, в значительной степени подавляется эритропоэз и начинается падение количества эритроцитов и гемоглобина.
Эритроциты, продуцированные внутриутробно, обладают укороченной длительностью жизни но сравнению со взрослыми и детьми более старшего возраста и более склонны к гемолизу. Длительность жизни эритроцитов у новорожденных в первые дни жизни составляет 12 дней, что в 5 — 6 раз меньше средненормальной длительности жизни эритроцитов детей старше года и взрослых.
Имеются и отличия в количестве лейкоцитов. В периферической крови в первые дни жизни после рождения число лейкоцитов до 5-го дня жизни превышает 18 — 20-109/л, причем нейтрофилы составляют 60— 70% всех клеток белой крови. Лейкоцитарная формула сдвинута влево за счет большого содержания палочкоядерных и в меньшей степени метамиелоцитов (юных). Могут обнаруживаться и единичные миелоциты.
Значительные изменения претерпевает лейкоцитарная формула, что выражается в падении числа нейтрофилов и увеличении количества лимфоцитов. На 5-й день жизни их число сравнивается (так называемый первый перекрест), составляя около 40 — 44% в формуле белой крови. Затем происходит дальнейшее возрастание числа лимфоцитов (к 10-му дню до 55 — 60%) на фоне снижения количества нейтрофилов (приблизительно 30%). Постепенно исчезает сдвиг формулы крови влево. При этом из крови полностью исчезают миелоциты, снижается число метамиелоцитов до 1 % и палочкоядерных —до 3%.
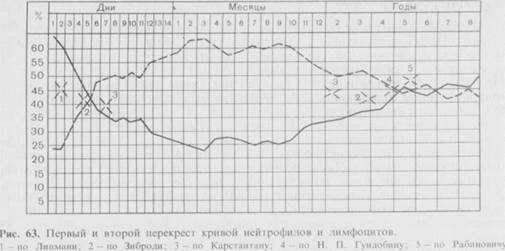
После года вновь увеличивается число нейтрофилов, а количество лимфоцитов постепенно снижается. В возрасте 4-5 лет вновь происходит перекрест в лейкоцитарной формуле, когда число нейтрофилов и лимфоцитов вновь сравнивается. В дальнейшем наблюдается нарастание числа нейтрофилов при снижении числа лимфоцитов. С 12 лет лейкоцитарная формула уже мало чем отличается от таковой взрослого человека.
ОНТОГЕНЕТИЧЕСКИЕ ОСОБЕННОСТИ ИММУННОЙ СИСТЕМЫ
При формировании и становлении иммунной системы в онтогенезе Ю.Е.Вельтищев (1989) предлагает выделять так называемые «критические» периоды развития иммунологической реактивности, которые не всегда совпадают с периодами развития ребенка, принятыми в педиатрии.
Прежде, чем охарактеризовать особенности так называемых «критических» периодов становления иммунной системы на внеутробном этапе развития ребенка, следует подчеркнуть, что во внутриутробной жизни плода также существует «критический» период, когда происходит дифференцировка органов и клеток в том числе и иммунной системы и именно этим фактором, помимо генетической детерминации, по-видимому, можно в ряде случаев объяснить, что малые и большие пороки развития органов и систем ребенка нередко сочетаются с дефектами в иммунной системе. Особенно это выражено у детей с поражениями ЦНС.
Первый «критический» период для иммунной системы ребенка во внеутробной жизни - это период новорожденности. В настоящее время доказано, что в том числе и в периоде новорожденности ребенок обладает набором неспецифических и специфических иммунологических факторов. В периоде новорожденности происходят значительные колебания в иммунной системе в связи с резким изменением условий существования. Так, после рождения почти все полости новорожденного заселяются микрофлорой.
Ребенок в момент рождения имеет сниженное, по сравнению с последующими возрастными периодами, процентное содержание лимфоцитов и Т-клеток.
Однако, из-за физиологического лейкоцитоза абсолютное содержание всей популяции лимфоцитов и Т-клеток оказывается достаточно высоким и нет основания говорить о количественном дефиците Т-системы новорожденного ребенка.
В возрасте 5 дней жизни ребенка происходит первый перекрест в содержании форменных элементов крови, в частности, увеличивается процентное содержание лимфоцитов. Абсолютное их число меняется мало, так как снижается лейкоцитоз, характерный для первых дней жизни ребенка. Пассивный гуморальный иммунитет обеспечивается материнскими антителами, относящимися к IgG - классу иммуноглобулинов, так как именно они проходят в силу своих физико-биохимических свойств через плаценту. У новорожденных отсутствует IgA в крови и, по-видимому, в связи с этим не функционирует система местного (автономного) иммунитета слизистых оболочек, так как известно, что молекула секреторного иммуноглобулина А (11S) (S IgA) состоит из двух молекул сывороточного IgA (7S), связанного с SC-компонентом и J-цепью. Синтез секреторного IgA начинается уже в первые месяцы жизни ребенка.
Все лимфоциты новорожденных имеют маркер незрелости. В-лимфоциты несут типичные антигены CD19, CD2O, CD23, CD25, однако они практически не способны к секреции иммуноглобулинов, за исключением IgM. У новорожденных отмечаются функциональная недостаточность фагоцитов и низкая активность естественных киллеров (NК-клеток), сочетающиеся с недостаточным синтезом гамма-интерферона.
В связи с этим, для новорожденных характерна склонность к генерализации бактериального воспаления - возникновению сепсиса. Установлено, что в этом периоде жизни ребенка отмечается низкая резистентность к условно-патогенной флоре, грамотрицательным, гноеродным бактериям и вирусам.
Несмотря на то, что способность к синтезу иммуноглобулинов антител IgG и IgA класса у новорожденных детей еще недостаточна (эти системы формируются постепенно, достигая максимума к 7 годам жизни ребенка), клеточный иммунитет, наряду с факторами неспецифической резистентности, материнские антитела, прошедшие трансплацентарно, а также секреторный IgA молозива и материнского молока обеспечивают защиту ребенка в этом периоде жизни от многих заболеваний вирусной и бактериальной природы.
Второй «критический» период (3-6 месяцев) характеризуется снижением пассивного гуморального иммунитета в связи с катаболизмом материнских иммуноглобулинов-антител. В этом периоде сохраняется супрессорная активность иммунных реакций при выраженном лимфоцитозе. На большинство инфекционных антигенов ребёнок отвечает развитием первичного иммунного ответа с преимущественным синтезом IgM антител, которые не оставляют иммунологической памяти. Такой тип иммунного ответа возникает и при вакцинации детей этого возраста против столбняка, дифтерии, коклюша, полиомиелита и кори. Только после второго и/или третьего введения дифтерийного и столбнячного анатоксина развивается вторичный иммунный ответ с образованием IgG антител и стойкой иммунологической памяти. Вакцинация у отдельных индивидуумов может не вызвать специфического иммунного ответа, если в крови детей ещё циркулируют материнские антитела, или, если дети получали по медицинским показаниям препараты крови: гамма-глобулин, плазму и др. дети этого возрастного периода сохраняют очень высокую чувствительность к респираторным вирусам. В этом возрасте атипично протекают корь, коклюш, не оставляя иммунитета. Проявляется недостаточность системы местного иммунитета, что может приводить к повторным ОРВИ, выявляются наследственные иммунодефициты, нарастает частота встречаемости пищевой аллергии. IgG снижен по сравнению с периодом новорожденности в 2 раза, но нарастает собственный синтез IgA антител от «0» в периоде новорожденности до 0,46 г/л в возрасте 4-6 месяцев.
Таким образом, выявлена определённая онтогенетическая последовательность созревания системы иммуноглобулинов разных классов: сначала появляется IgM, синтез которого идёт уже внутриутробно, потом начинается синтез IgG, а последним IgA.
По мере роста здорового ребёнка устанавливаются определённые соотношения между синтезом молекул IgA и свободного секреторного компонента. При этом почти всегда в секретах имеется избыток последнего.
Третий «критический» период – второй год жизни ребёнка. В это время значительно расширяются контакты ребёнка с внешним миром, ребёнок начинает свободно передвигаться. Сохраняется характер первичного ответа на многие антигены, однако синтез антител уже переключается на образование антител класса IgG, характерных для вторичного иммунного ответа. В этом периоде дифференцируются клоны В-лимфоцитов, синтезирующие субклассы IgG1 и IgG3. Однако, синтез субклассов IgG2 и IgG4 запаздывает. Содержание лимфоцитов в крови достигает максимальных значений. Нарастает и концентрация IgA.
Система местного иммунитета остается недостаточно развитой, дети чувствительны к респираторным вирусным инфекциям.
Полисахаридные антитела некоторых серотипов пневмококка не вызывают спе-цифический иммунный ответ, он также отсутствует по отношению к палочке инфлюенцы у 1/3 детей этого возраста. В этом периоде выявляются аномалии иммунитета, иммунокомплексные, аутоиммунные болезни, атопические заболевания. Дети все еще склонны к повторным вирусным и микробно-воспалительным заболеваниям органов дыхания.
Четвертый «критический» период - 4-6 годы жизни. В этом возрасте (около 5 лет) отмечается второй перекрест в содержании форменных элементов крови, в частности снижается относительное число лимфоцитов. Средняя концентрация IgG и IgМ в крови соответствует уровню такового у взрослых, уровень IgA в плазме крови в 4-6 лет еще не достигает окончательных значений, которые вдвое увеличиваются поcле 7 года жизни ребенка и достигают значений этого показателя у взрослых. Содержание IgE в крови достигает максимальной величины, характерной для здоровых детей, и не превышает 100-150 МЕ/мл. Система местного иммунитета у большинства детей завершает свое развитие также к 7 годам. Этот возрастной период характеризуется высокой частотой атопических, паразитарных, иммунокомплексных заболеваний, поздним проявлением иммунодефицитов. У ряда детей формируются хронические заболевания полигенной природы (хронические заболевания бронхолёгочной системы, хронический пиелонефрит, хронический нефрит и др.).
Пятый «критический» период - подростковый - совпадает с шестым периодом (это дети старшего школьного возраста с 12 до 17-18 лет) внеутробного этапа развития ребенка. Причем, в этом возрастном периоде бурного полового созревания девочки обгоняют мальчиков на 1-1,5 года. Именно поэтому подростковый период определяется для девочек возрастом 12-13 лет, а для мальчиков – 14-15 лет.
В связи с началом полового созревания обостряются хронические воспалительные заболевания, возможны отклонения в эндокринных железах в связи с гормональной перестройкой (развитие зоба, гипо- и гипертиреоза). В этом возрастном периоде отмечается новый скачок аутоиммунных лимфопролиферативных заболеваний.
Пубертатный скачок роста детей сопровождается снижением массы лимфоидной системы. В связи с гормональной перестройкой происходит снижение показателей клеточного иммунитета, сопровождающееся усилением функции гуморального иммунитета (СD19, В-лимфоцитов), полностью сформирована система местного иммунитета, классы и субклассы IgG и IgA в крови.
Гипотрофия (нарушение нутритивного статуса) – хроническое расстройство питания, характеризующееся дефицитом массы тела по отношению к росту и возрасту.
Причины развития гипотрофии при различных заболеваниях у детей можно условно разделить на 3 группы:
− недостаточное поступление пищевых веществ (дефицитное питание или затруднения при приёме пищи);
− нарушение переваривания и усвоения пищи (синдром мальабсорбции);
− неадекватное обеспечение повышенных потребностей в нутриентах (недоношенные дети, врожденные пороки сердца, хроническая патология легких, тяжелые инфекции, сопровождающиеся катаболическим стрессом и другие).
Факторы, предрасполагающие к развитию гипотрофии в постнатальном периоде
| Эндогенные факторы | Экзогенные факторы |
| − Врожденные пороки развития (сердечно-сосудистой системы, желудочно-кишечного тракта, мочеполовой системы, печени) − Врожденные или приобретенные поражения цнс (церебральная ишемия, перинатальное поражение нервной системы, внутричерепные кровоизлияния и др.) − Синдромы мальабсорбции (при лактазной недостаточности, целиакии, муковисцидозе, синдроме короткой кишки и др.) − Врождённые иммунодефицитные состояния − Некоторые эндокринные заболевания (пангипопитуитаризм, б-нь Аддисона, нарушения функции щитовидной железы и др.) − Наследственные нарушения обмена веществ − Длительная интоксикация при хронических инфекционных болезнях (туберкулёз, бруцеллёз и др.) и гнойных процессах (абсцессы, нагноившиеся бронхоэктазы, остеомиелит) − Тяжелые острые инфекционные заболевания, сопровождающиеся иртоксикацией, рвотой, частым стулом − Тяжелые неинфекционные заболевания (злокачественные опухоли, тяжёлая сердечная, дыхательная недостаточность и др.) − Тяжёлая термическая и сочетанная травма | - Алиментарные (количественный и качественный недокорм при естественном и искусственном вскармливании, неправильное введение прикорма, дефекты ухода) |
Классификация гипотрофий (по Е.В. Неудахину, 2001)
| Форма | Степень гипотрофии в зависимости от дефицита массы тела (%) |
| Пренатальная (внутриутробная) Постнатальная (приобретенная) | I степень 10 – 20% II степень 20 – 30% III степень 30% и более |
Классификация белково-энергетической недостаточности у детей (по Waterlow J.C., 1992)
| Степень/форма | Острая БЭН | Хроническая БЭН |
| % от долженствующей массы по росту | % от долженствующего роста по возрасту | |
| 0 (норма) | >90 | >95 |
| I (лёгкая) | 81-90 | 90-95 |
| II (средне-тяжёлая) | 70-80 | 85-89 |
| III (тяжёлая) | <70 | <85 |
Основные методы для оценки нутритивного статуса
| Клинические | Лабораторные |
| − Анамнестические данные − Клинический осмотр с учетом специфических симптомов гипотрофии и гиповитаминоза − Антропометрия с расчетом Z-score* − Измерение толщины кожно-жировых складок | − Содержание сывороточного альбумина и короткоживущих белков (транстиретин, ретинолсвязывающий белок, трансферрин) − Оценка иммунного статуса (иммунные маркеры гипотрофии – это абсолютная лимфопения, снижение соотношения CD4/CD8, задержка тестов гиперчувствительности - показателей клеточного иммунитета, снижение уровня иммуноглобулинов – гуморального иммунитета) |
*Z-score = (ИП – СЗ) / СО
ИП – индивидуальный показатель (массы тела, роста)
СЗ – среднее значение для данной популяции (массы тела, роста)
СО – стандартное отклонение среднего значения (=1,0)
Классификация БЭН у детей (% от долженствующей массы и Z–скор)
| Степень/Форма | Острая БЭН | Хроническая БЭН |
| % от долженствующей массы по росту и Z–скор | % от долженствующего роста по возрасту и Z–скор | |
| 0 (норма) | 90 – 110 +Z - -Z | 95 – 105 +Z - -Z |
| I (лёгкая) | 80 – 89 -1,1Z - -2Z | 90 – 94 -1,1Z - -2Z |
| II (средне-тяжёлая) | 70 – 79 -2,1Z - -3Z | 85 – 89 -2,1Z - -3Z |
| III (тяжёлая) | <70 <-3Z | <89 <-3Z |
Диагностика гипотрофии основывается на ряде клинических признаков, подсчете росто-весовых показателей и подтверждается выявлением степени дефицита массы в процентах с учетом возраста ребенка и, его роста.
Критериидиагностики
Клинические:
Выраженность клинических симптомов зависит от степени гипотрофии (I, II, III).
1. Кожа бледная, дряблая, при III степени морщинистая за счет потери эластичности.
2. Подкожно-жировой слой истончен на животе (N— 1,5 см), конечностях (N—1,5—2 см), при третьей степени гипотрофии он полностью отсутствует, сохранены лишь комочки Биша на щеках.
3. Снижение тургора тканей, мускулатура вялая, мышцы истончены.
4. Отставание в развитии моторных функций вплоть до временной потери статических умений (ребенок перестает сидеть, вставать на ноги, ходить).
5. Снижение индекса Чулицкой I—II, Эрисмана и др., указывающее на падение массы и нарушение пропорций тела.
6. Отставание в росте при гипотрофии II на 1—3 см, при III степени больше 3.
7. Уплощение кривой массы тела при I ст. гипотрофии, неправильный тип ее при более глубоких степенях болезни.
8. Снижение толерантности к пище (снижение аппетита, развитие диспепсических расстройств, изменение весовой кривой).
9. Исчезновение монотермии, превышение размаха суточных колебаний температуры тела более 0,5—0,6°С при II и III ст. гипотрофии.
10. Выраженный явный полигиповитаминоз (витаминов группы В; А, С).
11. Снижение иммунитета (присоединениеинтеркурентных заболеваний и развитие токсикосептического состояния).
12. Развитие дефицита массы тела от 10—20% при гипотрофии I ст., от 20 до 30 % при II ст. и более 30—-40 % при гипотрофии III ст.
Лабораторные
— снижение реактивности организма: падение показателей специфического (иммуноглобулина А, М, снижение титра антител) и неспецифического иммунитета (фагоцитоз,лизоцим).
Дифференциальную диагностику проводят между степенями гипотрофии. При постановке диагноза учитывают этиологию заболевания.
Date: 2015-07-02; view: 853; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |